
分析 根据所含元素化合降低的反应物是氧化剂,氧化剂被还原发生还原反应生成还原产物;所含元素化合价升高的反应物是还原剂,还原剂被氧化发生氧化反应生成氧化产物,据此结合元素化合价判断;
解答 解:对于反应:KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,反应中Mn元素化合价由KMnO4中+7降低为MnCl2中+2,KMnO4是氧化剂,Mn元素被还原,发生还原反应生成MnCl2,MnCl2是还原产物;Cl元素化合价由HCl中-1价升高为中0价,HCl是还原剂,Cl元素被氧化发生氧化反应生成Cl2,Cl2是氧化产物,又每生成1moL氯气转移电子为1mol×2=2mol,所以有2.5mol Cl2生成,则该反应中电子转移的物质的量为2.5mol×2=5mol.
故答案为:Mn;Cl;KMnO4;HCl;Cl2;MnCl2;5mol.
点评 本题考查常用氧化还原反应基本概念及其转移电子数的计算,难度不大,注意抓住化合价变化分析是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 蒸馏时,温度计的水银球应靠近蒸馏烧瓶的底部 | |
| C. | 容量瓶用水洗净后,可不经干燥直接用于配制溶液 | |
| D. | 配制1L0.1mol/L的NaCl溶液时可用托盘天平称量5.85gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
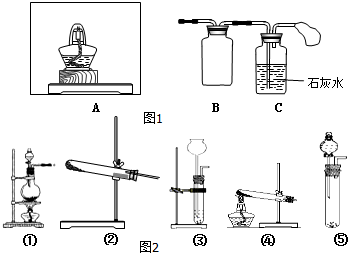 Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.8NA | |
| D. | 标准状况下,2.24 L已烷含有分子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得某溶液的pH为0 | |
| B. | 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝 | |
| C. | 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中 | |
| D. | 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com