
| A. | Cu(OH)2与盐酸 Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液 Ba(OH)2溶液与Na2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液 Na2CO3溶液与NaHSO4溶液 | |
| D. | 石灰石与硝酸 生石灰与盐酸 |
分析 A.CH3COOH为弱酸,应写成化学式,HCl为强电解质,写成离子;
B.两个反应的实质为SO42-和Ba2+的反应;
C.NaHCO3电离出HCO3-,Na2CO3电离出CO32-;
D.石灰石为碳酸钙,生石灰为CaO.
解答 解:A.反应的离子方程式分别为:Cu(OH)2+2H+=Cu2++2H2O、Cu(OH)2+2CH3COOH=Cu2++2H2O+2CH3COO-,二者不同,故A错误;
B.两个反应的实质都为SO42-和Ba2+的反应,离子方程式都为SO42-+Ba2+=BaSO4↓,符合条件,故B正确;
C.NaHCO3电离出HCO3-,Na2CO3电离出CO32-,反应物不同,离子方程式不同,故C错误;
D.石灰石的化学式为CaCO3,生石灰的化学式为CaO,反应物不同,离子方程式不同,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确发生反应的实质为解答关键,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体和其它分散系的本质区别是丁达尔效应 | |
| B. | 用四氯化碳萃取碘水中的碘单质时,上层液体呈紫红色 | |
| C. | 蒸馏时,蒸馏烧瓶加沸石是为了防止暴沸,冷凝管上口进水、下口出水 | |
| D. | 可用丁达尔效应区分溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 铁器在潮湿的空气中生锈 | D. | NaHCO3转化为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
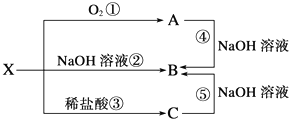
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1mol/L的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | c(Fe2+)=0.1mol/L的溶液:H+、Al3+、NO3-、SCN- | |
| D. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①②⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
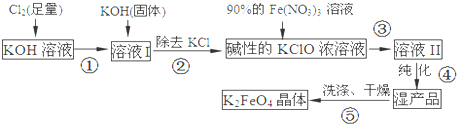
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com