
| A、含有阴离子的化合物一定含有阳离子,含有阳离子的化合物不一定含有阴离子 |
| B、只含化学键而无分子间作用力的化合物晶体一定是原子晶体 |
| C、质子数和电子数均相同的两种微粒不可能是一种分子和一种离子 |
| D、只有分子中所有原子均达到2个或8个电子稳定结构的分子才是稳定分子 |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、向0.02mol?L-1 CH3COOH溶液中加入等体积0.01mol?L-1 NaOH溶液,测得溶液中c(CH3COO-)>c(Na+),则水的电离程度比纯水的大 |
| B、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=1×10-8mol?L-1 |
| C、等物质的量浓度的NH4Cl溶液和NH3?H2O溶液中,c(NH4+)前者小于后者 |
| D、等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,当有3NA个电子转移时,上述反应的△H变为-46.2kJ?mol-1 |
| B、标准状况下,1.12L HCHO中氧原子的数目为0.05NA个 |
| C、由6.8g HCOONa和少量HCOOH形成的中性溶液中,CH3COO-数目为0.1NA个 |
| D、5.8g熟石膏(2CaSO4?H2O)含有的钙离子数为0.04NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大力发展工业除尘技术,严控PM2.5 |
| B、向含重金属离子的工业废水中加入明矾,然后再将废水排放 |
| C、将炼铁时产生的高炉矿渣加工成多种工业原料 |
| D、推进燃油的品质升级,致力于缓解雾霾产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
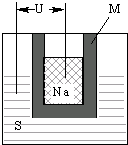 美国福特(Ford)公司于1967年首先发明公布的钠硫电池由于具有高能的诱人特点,受到很多国家极大的重视和发展.图1为钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,下列叙述正确的是( )
美国福特(Ford)公司于1967年首先发明公布的钠硫电池由于具有高能的诱人特点,受到很多国家极大的重视和发展.图1为钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,下列叙述正确的是( )| A、M只是用来隔离Na和S |
| B、正极的电极反应式为xS+2e?→Sx2? |
| C、与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的4倍 |
| D、Na+在电池工作过程中朝负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B、标况下,22.4L四氯化碳所含分子数大于NA |
| C、0.1mol/L 的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D、标准状况下,11.2L HF含有的HF分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 充电 |
| A、放电时,CH3OH参与反应的电极是负极,发生了还原反应 |
| B、充电时,电解质溶液的PH逐渐增大 |
| C、放电时,负极的电极反应离子方程式:CH3OH+8OH--6e-═CO32-+6H2O |
| D、用该电池电解CuCl2溶液,产生3.36L Cl2(标准状况)时,消耗甲醇为1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2c(CO32-)+c(HCO3-)=0.1mol/L | ||||
B、
| ||||
| C、该溶液中加BaCl2溶液,溶液pH增大 | ||||
| D、在溶液中加水,使体积扩大到原来的10倍,则溶液pH明显变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
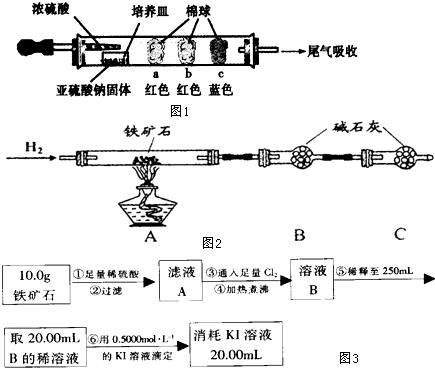
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 该气体具有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com