
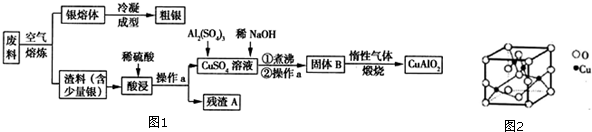
分析 由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水;增大接触面积,加快反应速率;
(2)CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO;
(3)由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,配平完成方程式;
(4)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag的质量与Cu质量之差,根据电子转移守恒计算Cu放电时析出Ag的质量,即为两个电极上银质量的变化值之差;
(5)由均摊法计算氧化亚铜晶胞中Cu原子和O原子的数目,根据密度计算公式ρ=$\frac{m}{V}$计算即可.
解答 解:由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)由上述分析可知,空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水,反应离子方程式为:CuO+2H+=Cu2++H2O;将渣料粉碎,增大接触面积,加快反应速率;
故答案为:CuO+2H+=Cu2++H2O;将渣料粉碎;
(2)操作a是分离互不相溶的液体与固体,应是过滤,CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝,现象为得到蓝色溶液、有红色固体生成;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO,溶液变蓝色,相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生,
故答案为:过滤;相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生;
(3)由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,反应前Cu为+2价,反应后为+1,化合价降低1,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:4; 2; 4CuAlO2;O2;
(4)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag与Cu的质量之差,设Cu为xmol,根据电子转移守恒,则Cu放电形成Ag为2x mol,故2x×108-64x=30.4,解得x=0.2,两个电极上银质量的变化值之差为Cu放电生成Ag的质量,故为0.2mol×2×108g/mol=43.2g,
故答案为:43.2;
(5)O原子在晶胞的顶点和体心,故O原子数=8×$\frac{1}{8}$=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,则该氧化物的密度ρ=$\frac{m}{V}$=$\frac{320}{{a}^{3}×{N}_{A}}$g/cm3.
故答案为:$\frac{320}{{a}^{3}×{N}_{A}}$.
点评 本题以从废料中回收银并制备铜化工产品载体,考查化学工艺流程、物质分离提纯、电解原理、氧化还原反应配平与计算,计算中抓住电子转移守恒进行解答,难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①③均属于置换反应 | |
| B. | 反应①中氧化产物和还原产物的质量比为1:2 | |
| C. | 该流程中反应①③的还原剂不能互换使用 | |
| D. | 该流程是实现半导体工业“从沙滩到用户”的基础 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+3 | B. | n+4 | C. | n-6 | D. | n-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
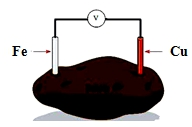
| A. | Fe用作正极 | B. | Cu片质量减少 | ||
| C. | 电子由Fe并经导线流向Cu片 | D. | 实现了电能向化学能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6Li和7Li的电子数相等,中子数也相等 | |
| B. | 1H和2H是不同的核素,它们的质子数相等 | |
| C. | 14C和14N的质量数相等,它们的中子数不等 | |
| D. | 13C和14C属于同一元素,它们互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com