
【题目】将2.5g NaOH、NaHCO3、Na2CO3固体粉末溶于水,制成溶液,然后逐渐向其中滴加1mol/L的盐酸,所加入盐酸的体积与产生的CO2的体积(标准状况)的关系如图像所示:

(1)写出OA段发生的离子反应方程式___________________、___________________________
(2)当加入35mL盐酸时,产生CO2的体积为_________________(标准状况)
(3)原混合物中NaOH的质量为_______________
【答案】H++ OH-= H2O CO32+ H+= HCO3 - 224mL 0.6g
【解析】
(1)OA段是氢氧化钠和盐酸反应,再是碳酸钠和盐酸反应生成碳酸氢钠;
(2)25mL—45mL阶段是碳酸氢根和氢离子反应,当加入35mL盐酸时,此时有10mL盐酸用于生成二氧化碳气体,再根据方程式进行计算;
(3)设NaOH、NaHCO3、Na2CO3物质的量分别为x、y,z,建立方程式计算。
(1)OA段是氢氧化钠和盐酸反应,再是碳酸钠和盐酸反应生成碳酸氢钠,因此发生的离子反应方程式H++ OH- = H2O、CO32-+ H+ = HCO3-,故答案为:H++ OH- = H2O、CO32-+ H+= HCO3-;
(2)25mL—45mL阶段是碳酸氢根和氢离子反应,当加入35mL盐酸时,此时有10mL盐酸用于生成二氧化碳气体,且消耗盐酸与产生CO2的比例是1:1,即体积为1 mol/L × 0.01 L × 22.4 L/mol = 0.224L=224mL,故答案为:224mL;
(3)设NaOH、NaHCO3、Na2CO3物质的量分别为x、y,z,建立方程组为:y + z = 0.02 mol,x + z = 0.025mol,40x + 84y + 106z = 2.6g,解得x = 0.015 mol,y = 0.01 mol,z = 0.01 mol,因此粉末原混合物中NaOH的质量为0.015mol×40g/mol = 0.6g,故答案为:0.6g。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
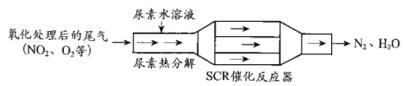
①尿素水溶液热分解为NH3和CO2,该反应的化学方程式:___。
②反应器中NH3还原NO2的化学方程式:___。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:__。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol-1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是__。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
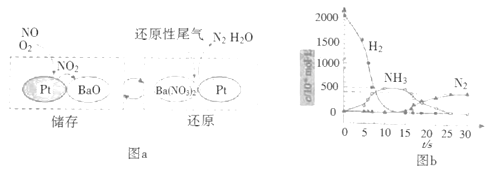
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是__。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___![]() □15NNO+□H2O___。
□15NNO+□H2O___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2mol/LNaOH溶液500mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是________________________________(填仪器名称)。
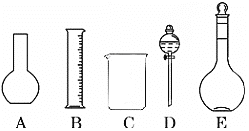
(2)现用质量分数为98%、密度为1.84gcm-3的浓硫酸来配制450mL、0.5molL-1的稀硫酸。计算所需浓硫酸的体积为______mL(保留1位小数),现有①10mL ②25mL③50mL ④100mL四种规格的量筒,你选用的量筒是_____(填代号).
(3)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序
为:②→①→③→___→___→___→___→④(填序号)
(4)在配制过程中,其他操作都准确,下列操作中错误的是_______,能引起误差偏高的有___________(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年全球气候变暖,造成北极冰川大面积融化,其罪魁之一就是CO2,如何吸收大气中的CO2,变废为宝,是当今化学研究的主题之一。
I.二甲醚可用作溶剂、冷冻剂喷雾剂等,科学家提出利用CO2和H2合成二甲醚,反应原理为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H
CH3OCH3(g)+3H2O(g) H
(1)已知:①H2O(g)+CO(g)![]() CO2(g)+H2(g) △H1=+42kJ/mol
CO2(g)+H2(g) △H1=+42kJ/mol
②CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) H2=+24.52kJ/mol
2CH3OH(g) H2=+24.52kJ/mol
③CH3OH(g)![]() CO(g)+2H2(g) H3=+90.73kJ/mol
CO(g)+2H2(g) H3=+90.73kJ/mol
则H=__kJ/mol。
(2)一定温度下,在一个2L的密闭容器中充入2molCO2和6molH2发生上述反应,经过5min反应达到平衡,此时容器中压强与起始压强之比为3:4,则用CH3OCH3表示的平均反应速率为__,H2的转化率为___;此时若向体系中再加入2molCO2和1.5molH2O(g),平衡__移动(填正向、逆向、不)。
(3)对于恒温恒容条件下进行的反应①,下列说法能说明反应已达平衡的是__。
A.混合气体密度不发生改变
B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=v(H2)逆
D.n(CO)与n(H2)的比值不变
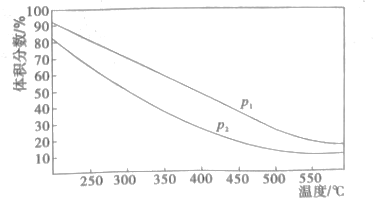
(4)一定温度下,密闭容器中进行的反应③,测得平衡时混合物中某物质的体积分数在不同压强下随温度的变化如图所示,则纵坐标表示的物质是__,压强P1_P2(填>、<)。
II.工业锅炉长期煮烧会形成锅垢(主要成分CaSO4、Mg(OH)2),必须定期除去。
(5)CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO32-=CaCO3+SO42-,室温下,该反应的化学平衡常数为__(室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用一种石油化工产品A(C4H6)为原料合成两种含卤素的有机化合物的合成路线如图。
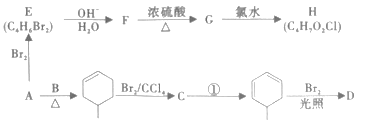
已知:Ⅰ.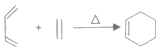 ;
;
II.E的核磁共振氢谱有两个吸收峰且能使溴的四氣化碳溶液褪色;
III.D分子不含甲基,G的分子式为C4H6O,且结构对称。
回答下列问题:
(1)A的系统命名为__,B的结构简式为__。
(2)A→E的反应类型为__,由G和氯水中的某一种成分发生加成反应生成H(不含经基)的化学方程式为__。
(3)下列有关说法正确的是__。
A.烃A的所有原子可能在同一平面上
B.G的一种同分异构体可能发生银镜反应
C.D的结构简式为![]()
D.将nmolA和nmolB通过加聚反应得到高聚物的聚合度为2n
(4)H的同分异构体中含有羧基的结构有__种,写出其中一种在核磁共振氢谱上有2组峰的有机物的结构简式__。
(5)结合上述合成路线中的信息写出以A和乙醇为起始原料合成氯环己烷的路线__。(无机原料自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2FeCl2+Cl2=2FeCl3。现有铁粉、氯气、氧化铁和盐酸四种物质,试用三种方法制取FeCl3(用化学方程式表示)。
(1)___________________。
(2)__________________。
(3)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量相等的铁片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图1的装置:

(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,
(2)铜片周围溶液会出现___________的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2 g,计算:导线中流过的电子的物质的量为__________mol;
(4)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。
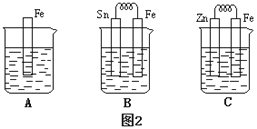
①图2 B中的Sn为________极,Sn极附近溶液的pH(填“增大”“减小”或“不变”)____。
②图2 C中被腐蚀的金属是___________。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______。
(5)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
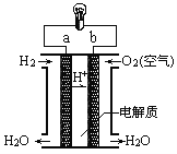
①氢氧燃料电池的正极电极反应是:___________________。电池工作一段时间后硫酸溶液的浓度_____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 常温下,可以与H2化合生成液态化合物
D. 其电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
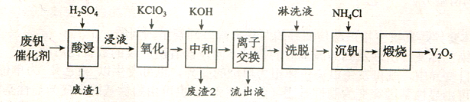
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com