
【题目】(1)在AlCl3溶液中滴加过量的氨水,反应的化学方程式为__________________。
(2)碳酸氢钠与稀硫酸反应的离子方程式__________________;铜与浓硫酸共热反应的化学方程式__________________。
(3)现有0.284kg质量分数为10%的Na2SO4溶液,则溶液中Na2SO4的物质的量为______;配制250mL2.0mol/LH2SO4溶液,需要18mol/LH2SO4溶液的体积_________mL。
(4)同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子的电子层数逐渐____________,原子半径逐渐____________;失电子能力逐渐____________,金属性逐渐____________ ;得电子能力逐渐 ___________,非金属性逐渐____________ 。
(5)A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;E元素原子最外层电子数比次外层电子数少1。回答下列问题:
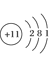
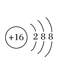
写出E元素的元素符号:________画出B、C的原子结构示意图:B.________C________画出D的离子结构示意图:________。
【答案】AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl HCO3-+H+=H2O+CO2↑ Cu+2H2SO4(浓)=CuSO4 + 2H2O+ SO2↑ 0.2 mol 27.8 增加 增大 增强 增强 减弱 减弱 Cl ![]()
【解析】
(1)(2)根据条件写出化学方程式或离子方程式;
(3)根据公式![]() 和
和![]() 计算;
计算;
(4)同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子的电子层数逐渐增加,原子半径逐渐增大;失电子能力逐渐增强,金属性逐渐增强;得电子能力逐渐减弱,非金属性逐渐减弱。
(5)A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;E元素原子最外层电子数比次外层电子数少1。则A为H;B为O;C为Na;D为S;E为Cl。以此答题。
(1)在AlCl3溶液中滴加过量的氨水,反应的化学方程式为 ![]() ,故答案为:
,故答案为:![]() ;
;
(2)碳酸氢钠与稀硫酸反应的离子方程式为![]() ,铜与浓硫酸共热反应的化学方程式
,铜与浓硫酸共热反应的化学方程式![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)0.284kg质量分数为10%的Na2SO4溶液,则溶质质量为![]() ,则溶液中Na2SO4的物质的量为
,则溶液中Na2SO4的物质的量为![]() ;配制250mL2.0mol/LH2SO4溶液,需要18mol/LH2SO4溶液的体积
;配制250mL2.0mol/LH2SO4溶液,需要18mol/LH2SO4溶液的体积![]() ,故答案为:0.2 mol;27.8;
,故答案为:0.2 mol;27.8;
(4)同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子的电子层数逐渐增加,原子半径逐渐增大;失电子能力逐渐增强,金属性逐渐增强;得电子能力逐渐减弱,非金属性逐渐减弱。故答案为:增加;增大;增强;增强;减弱;减弱;
(5)A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;E元素原子最外层电子数比次外层电子数少1。则A为H;B为O;C为Na;D为S;E为Cl;则E元素的元素符号:Cl;B、C的原子结构示意图:![]() ;
;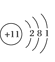 ;D的离子结构示意图:
;D的离子结构示意图: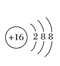 ;故答案为:Cl;
;故答案为:Cl;![]() ;
; ;
; 。
。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图是两种具有相同分子式的有机物—邻羟基苯甲酸和对羟基苯甲酸的结构式。已知它们的沸点相差很大,你认为哪一种沸点较高?______________,如何从氢键的角度来解释?______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率、化学反应限度的说法中,正确的是( )
A.反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B.用铁片与稀硫酸反应制H2,改用 98%的浓硫酸可加快生成H2的速率
C.反应2SO2(g)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
D.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 L0.1 mol·L-1 氨水中含有0.1NA NH3分子
B.46 g NO2和N2O4混合气体中含有的原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g14C所含中子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)A+和B-的电子层结构都与氩相同,A+的结构示意图为___;
(2)碳原子核外有___种能量不同的电子,分布在___个轨道中;
(3)鉴别碳原子可以利用其激发态原子跃迁到基态所形成的特征___(吸收或发射)光谱;
(4)水、SiO2、硫三种物质沸点由大到小的顺序为___;
(5)下列变化:H-(g)=H(g) +e-吸收的能量为73kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311kJ·mol-1,则氢负离子H-的第一电离能为___;
(6)短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。四种原子半径的由大到小顺序___(元素符号表示),能证明W、Z两元素非金属性强弱的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
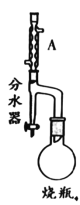
【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
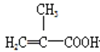 +CH3OH
+CH3OH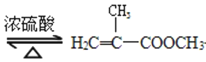 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明不含结晶水的X(由4种短周期元素组成),可作为氧化剂和漂白剂,被广泛应用于蓄电池工业等。为探究X的组成和性质,设计并完成了下列实验:
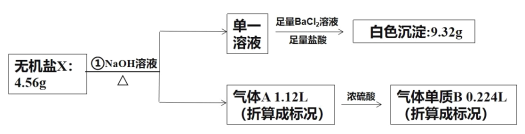
已知:气体单质B可使带火星的木条复燃。
(1)X中含有的元素为:____;图中被浓硫酸吸收的气体的电子式为:_____。
(2)请写出①的化学方程式:_____。
(3)已知X常用于检验Mn2+,它可将Mn2+氧化成MnO4-。请写出X溶液和少量MnCl2溶液反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用符号表示下列核素或同位素。
(1)质子数为![]() ,中子数为
,中子数为![]() 的
的![]() 原子:______。
原子:______。
(2)质子数和中子数都为9的氟原子:______。
(3)中子数为2的氢原子:______。
(4)中子数分别为8、9、10的氧原子:______。
(5)质量数分别为35、37的氯原子: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是
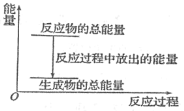
A.反应过程中的能量关系可用上图表示
B.1 mol Zn的能量大于1 mol H2的能量
C.若将其设计为原电池,则其能量转化形式为电能转化为化学能
D.若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com