
| A. |  | B. |  | C. | 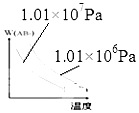 | D. | 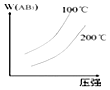 |
分析 该反应为气体体积减小、且放热的反应,则升高温度平衡逆向移动,增大压强平衡正向移动,且增大压强、升高温度反应速率均加快,以此来解答.
解答 解:A.为放热反应,升高温度,正逆反应速率均增大,且平衡逆向移动,逆反应速率大于正反应速率,与图象一致,故A正确;
B.为放热反应,升高温度,反应速率增大,且平衡逆向移动,则温度高时w(AB3)小,与图象一致,故B正确;
C.该反应为气体体积减小的反应,增大压强平衡正向移动,则w(AB3)增大,与图象不一致,故C错误;
D.等压时温度低平衡正向移动对应w(AB3)大,等温时压强大平衡正向移动对应w(AB3)大,与图象一致,故D正确;
故选C.
点评 本题考查化学平衡的移动,为高频考点,把握温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点及图形分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
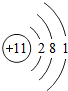 ;铝原子的结构示意图是
;铝原子的结构示意图是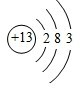 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
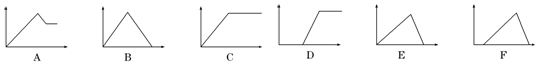
| 溶液 | 加入的物质 | 字母代号 |
| ①饱和石灰水 | 通过量CO2 | B |
| ②AlCl3溶液 | 通过量NH3 | C |
| ③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | A |
| ④AlCl3溶液 | 逐滴加NaOH溶液至过量 | E |
| ⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | F |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 气态氢化物共价键越强,热稳定性越高 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氢键是化学键的一种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 苯(苯酚):加入浓溴水,过滤 | |
| C. | 乙醇(水):加入金属钠,蒸馏 | |
| D. | 乙烷(乙烯):通入酸性高锰酸钾溶液,洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com