
 (08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
(08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
装置制取乙酸乙酯粗产品,再测定乙酸乙酯的含量。
⑴写出此反应的化学方程式
;
该反应要在浓硫酸存在的条件下进行,浓硫酸的作用是
;
⑵实验室一般用饱和碳酸钠溶液接收反应的生成物。若不
振荡该试管,可看到的现象是 ,若振
荡该试管,可看到的现象是 ,但有时却出现了白色晶体,该晶体是 ;
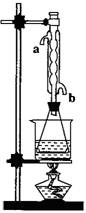 ⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
一条改进意见:
。
⑷为测定乙酸乙酯的含量,进行了如下操作:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol/L
NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为
40.0mL;
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL
2.1mol/LNaOH溶液混合均匀后,装上冷凝管,在水浴上加热回
流约1小时,装置如图所示。待冷却后,用0.50mol/LHCl滴定
过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答:
①实验(I)中达到滴定终点时的现象是 。
②实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
③利用实验(I)、(II)测量的数据计算粗产物中乙酸乙酯的质量分数为 。
科目:高中化学 来源: 题型:
2(08浙江省开化中学模拟)实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
 |
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ①
② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
查看答案和解析>>
科目:高中化学 来源: 题型:
(08皖南8校第三次联考)1 L某混合溶液,可能含有的离子如下表:
可能大量还有的阳离子 |
|
可能大量还有的阴离子 |
|
 (1)往该溶液中逐滴加入
(1)往该溶液中逐滴加入![]() 溶液并适当
溶液并适当
加热,产生沉淀和气体的物质的量(![]() )
)
与加入![]() 溶液的体积(V)的关系
溶液的体积(V)的关系
如右图所示。则该溶液中确定含有的离子
有_______________;不能确定是否含有
的阳离子有______________,要确定其存
在可补充做的实验是___________;肯定不存在的阴离子有_________________。
(2)经检测,该溶液中含有大量的![]() ,若向1 L该混合溶液中通入―定晕的
,若向1 L该混合溶液中通入―定晕的![]() ,溶液中
,溶液中![]() 的物质的量与通入
的物质的量与通入![]() 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()
(08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()
A.利尿酸衍生物利尿酸甲酯的分子式是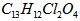
B.1mo1利尿酸最多能与4 mol![]() 发生加成反应
发生加成反应
C.利尿酸分子内处于同一平面上的原子数不少于12个
D.利尿酸能与 溶液发生显色反应
溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(08安徽信息卷)一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为: 。下列说法正确的是()
。下列说法正确的是()
 A.a极为电池的正极
A.a极为电池的正极
B.电池正极的电极反应为:
C.电池工作时电流由a极沿导线经灯泡再到b极
D.设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6 厍仑的电量
厍仑的电量
查看答案和解析>>
科目:高中化学 来源: 题型:
(08安徽模拟)合肥某院校研究出的甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H2=-192.9KJ/mol
下列说法正确的是 ()
A.根据②推知:在25℃,101kPa时,lmolCH3OH (g)燃烧生成
CO2 和HZO(l)放出的热量应大于192.9kJ
B.反应②中的能量变化如右图所示,则△H2=E1一E3
C.H2燃烧能放出大量的热,故CH30H转变成H2的过程必须吸收能量
D.根据盖斯定律,可以推出氢气和氧气反应生成1mol液态水的反应热。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com