
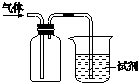
| A. | 该装置可用于收集NO2,试剂为水,用于吸收多余的NO2 | |
| B. | 若试剂是紫色石蕊试液,通入Cl2,溶液先变红后褪色,则氯气有漂白性 | |
| C. | 该装置可用于收集NH3,试剂为水,用于吸收多余的NH3 | |
| D. | 若试剂是酸性KMnO4溶液,通入SO2,溶液褪色,则得出SO2有还原性 |
分析 由实验装置可知,气体的密度比空气密度大,利用向上排空气法收集,或试剂瓶为除杂装置,结合物质的性质来解答.
解答 解:A.二氧化氮与水反应,则试剂为水,可发生倒吸,故A错误;
B.氯气不具有漂白性,氯气与水反应生成的HClO具有漂白性,故B错误;
C.氨气的密度比空气密度小,不能利用向上排空气法收集,且水为试剂可发生倒吸,故C错误;
D.SO2的密度比空气密度大,利用向上排空气法收集,且试剂为KMnO4溶液,通入SO2,发生氧化还原反应溶液褪色,则得出SO2有还原性,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质及现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:多选题
| A. | 物质B的转化率增大 | B. | 平衡向正反应方向移动 | ||
| C. | 物质A的体积分数增大 | D. | a+b<m+n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Ca2+的浓度减小 | B. | 溶液质量增大 | ||
| C. | 溶液中Ca(OH)2的质量分数不变 | D. | 溶液中OH-的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 | |
| B. | 若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 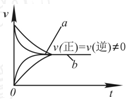 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图表示 | |
| D. | 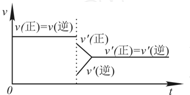 若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 有机物X的分子式为Cl2H15O | |
| B. | X分子不能使酸性高锰酸钾溶液褪色 | |
| C. | X分子中一定在同一个平面内的碳原子最多6个 | |
| D. | 在Ni作催化剂的条件下,1molX最多能与4molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 结构 | 某些性质 |
| 草酸 | 分子式:H2C2O4•2H2O | 无色,易溶于水;其钠盐和钾盐易溶于水,钙盐难溶于水 |
| 结构简式:HOOC-COOH | 熔点:101℃;升华温度:125℃;170℃以上分解 |
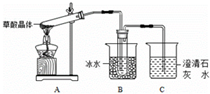
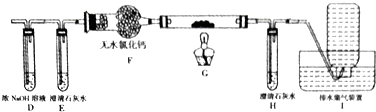
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com