
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
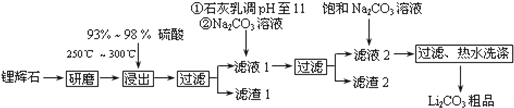
分析 锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)经过研磨、加热、酸化得到可溶性的硫酸锂、硫酸铝和不溶的二氧化硅,经过过滤,得到滤渣1二氧化硅,滤液1经过调节PH值,使溶液得到滤液Mg(OH)2和CaCO3.向滤液1中加入石灰乳以增加Ca2+、OH-的浓度,使Mg(OH)2、CaCO3更利于析出,以便形成滤渣2,热水洗涤Li2CO3的溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂,
解答 解:锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)经过研磨、加热、酸化得到可溶性的硫酸锂、硫酸铝和不溶的二氧化硅,经过过滤,得到滤渣1二氧化硅,滤液1经过调节PH值,使溶液得到滤液Mg(OH)2和CaCO3.向滤液1中加入石灰乳以增加Ca2+、OH-的浓度,使Mg(OH)2、CaCO3更利于析出,以便形成滤渣2,热水洗涤Li2CO3的溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂,
(1)滤渣1$→_{Ⅰ}^{()}$□$→_{Ⅱ}^{()}$□$→_{Ⅲ}^{灼烧}$Al2O3,滤渣1是Al2O3•4SiO2•H2O,先加酸溶解,然后过滤出不溶物二氧化硅,步骤Ⅱ中在铝离子的酸溶液中滴入氨水,生成氢氧化铝沉淀,所以步骤Ⅱ反应是铝离子生成氢氧化铝的反应,反应离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)石灰乳是氢氧化钙,提供氢氧根离子和钙离子,更完全的沉淀镁离子和碳酸根离子,离子反应方程式为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,故答案为:增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出;Mg2++Ca(OH)2=Mg(OH)2+Ca2+;
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”,图表中碳酸锂溶解度随温度升高减小,减少沉淀的损失,
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(4))①Li2CO3溶于盐酸作电解槽的阳极液,阳极液中氯离子失电子,发生氧化反应,所以阳极反应为2C1--2e-=Cl2↑,
故答案为:2C1--2e-=Cl2↑;
②电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂的方程式为:2LiOH+NH4HCO3=Li2CO3+NH3+2H2O,
故答案为:2LiOH+NH4HCO3=Li2CO3+NH3•H2O+H2O.
点评 本题考查了物质生产流程的分析判断,流程分析,物质性质的应用是解题关键,主要是铝及其化合物性质的应用,氧化铝的提取方法,题目难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 化学反应中的能量变化通常表现为热量的变化 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
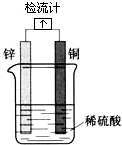
| A. | 锌是负极,其质量逐渐减轻 | |
| B. | 氢离子在铜的表面被还原,产生气泡 | |
| C. | 检流计的指针向右偏转 | |
| D. | 电流从锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6gNO2和N2O4的混合气体中氧原子数小于0.2NA | |
| B. | 1 L 0.1 mol.L-1的Na2S溶液中离子总数小于0.3NA | |
| C. | 在标况下,2.24 L CCl4含有0.4NA个Cl原子 | |
| D. | 0.1 mol H2O2参加氧化还原反应时,不一定转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加过量盐酸 CO32-+2H+=H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+=H2O+CO2↑ | |
| D. | .氢氧化钡溶液中加入硫酸 H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com