
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中生成白色沉淀的化学方程式:____。
(3)硬质玻璃管中的反应现象为__,反应的化学方程式为___。
(4)装置中空试管的作用是____。
(5)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为____。
【答案】通入氯气排尽装置中的空气 Cl2+H2O=HCl+HClO、HCl+AgNO3=AgCl↓+HNO3 剧烈反应,产生棕黄色的烟 Cu+Cl2![]() CuCl2 防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂 吸收尾气中的氯气,防止污染空气 Cl2+2NaOH=NaCl+NaClO+H2O
CuCl2 防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂 吸收尾气中的氯气,防止污染空气 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)铜容易被空气中氧气反应,因此装置中必须排除空气;
(2)氯气溶于水会生成盐酸与次氯酸,其中盐酸与硝酸银会反应生成氯化银白色沉淀,据此分析书写涉及的化学方程式;
(3)根据铜与氯气反应生成氯化铜的实验现象分析作答,注意颜色变化;
(4)干燥的氯气与铜粉在加热的条件下反应,若有水蒸气进入发生装置可能会发生试管炸裂,据此分析空试管的作用;
(5)氯气有毒,需用碱液吸收。
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作应该为:通入氯气排尽装置中的空气;
(2)氯水中存在氯离子,能与银离子反应生成氯化银,故白色沉淀为氯化银,反应的化学方程式为:Cl2+H2O=HCl+HClO;HCl+AgNO3=AgCl↓+HNO3;
(3)干燥的氯气与铜粉在高温下剧烈反应生成氯化铜,产生棕黄色的烟,化学方程式为:Cu+Cl2![]() CuCl2,故答案为:剧烈反应,产生棕黄色的烟;Cu+Cl2
CuCl2,故答案为:剧烈反应,产生棕黄色的烟;Cu+Cl2![]() CuCl2;
CuCl2;
(4)空试管的作用是:防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂;
(5)氢氧化钠溶液可吸收尾气中的氯气,防止污染空气,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:吸收尾气中的氯气,防止污染空气;Cl2+2NaOH=NaCl+NaClO+H2O。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解l9.2g(已知硝酸只被还原为NO气体,下同)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列说法正确的是( )

A. c点时,溶液中的溶质为Fe2(SO4)3
B. ab段发生反应的离子方程式为:Fe+Fe3+=2Fe2+
C. 原混和酸中稀硝酸的物质的量浓度为0.4mol/L
D. 原混和酸中稀硫酸的物质的量浓度为4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机乙偶姻存在于啤酒中,是酒类调香中一个极其重要的品种,某研究性学习小组为确定乙偶姻的结构,进行如下探究。
步骤一:将乙偶姻蒸气通过热的氧化铜(催化剂)氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收,如图1。2.64 g乙偶姻的蒸气氧化产生5.28 g二氧化碳和2.16 g水。
步骤二:升温使乙偶姻汽化,测其密度是相同条件下H2的44倍
步骤三:用核磁共振仪测出乙偶姻的核磁共振氢谱如图2,图中4个峰的面积比为1∶3∶1∶3。
步骤四:利用红外光谱仪测得乙偶姻分子的红外光谱如图3。



(1)图1装置中两支U型管不能互换的理由是__________________________.
(2)乙偶姻的摩尔质量为____________。
(3)乙偶姻的分子式为____________________。
(4)乙偶姻的结构简式为 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2二溴乙烷。其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴。可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。(夹持装置已略去)

有关数据列表如下:

填写下列空白:
(1)A的仪器名称是____。
(2)安全瓶B可以防止倒吸,还可以检查实验进行时导管是否发生堵塞。请写出发生堵塞时瓶B中的现象____。
(3)A中发生反应的化学方程式为:____;D中发生反应的化学方程式为:____。
(4)在装置C中应加入____(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)若产物中有少量副产物乙醚,可用___(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物分子式为RnH2O,其相对分子质量为M,25℃时,a g晶体溶于b g水中即饱和,形成V ml密度为ρ g/cm3的溶液,下列不正确的是 ( )
A. 饱和溶液的质量分数为![]() B. 25℃,R的溶解度为
B. 25℃,R的溶解度为![]() g
g
C. 饱和溶液的质量分数为![]() D. 饱和溶液物质的量浓度为
D. 饱和溶液物质的量浓度为![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() (螺[2,2]戊烷)的说法正确的是
(螺[2,2]戊烷)的说法正确的是
A. 一氯代物的结构只有一种
B. 与戊烯互为同分异构体
C. 所有碳原子均处同一平面
D. 能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是可被细菌作为碳源和能源利用的聚合物,属于一种生物可降解高分子材料,在食品、药品包装方面具有独特优势。已知A~G均为有机化合物,以下为高分子化合物G的一种合成路线:
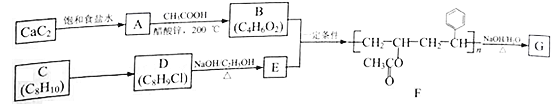
回答以下问题:
(1)由CaC2制备A的化学方程式为_________________________________。
(2)A生成B的反应类型为______________________。
(3)C的化学名称是___________,C→D所需试剂和条件分别是___________、___________。
(4)E的结构简式为______________________。
(5)芳香族化合物H是D的同分异构体,则H可能的结构共有___________种(不包括D),写出核磁共振氢谱有三组峰且峰面积之比为1︰2︰6的H的同分异构体的结构简式___________(任写一种)。
(6)由F生成G的化学方程式为_________________________________。
(7)参考题中信息,设计由1,2二氯乙烷和冰醋酸为原料制取![]() 的合成线路图(无机试剂任选)__________________。
的合成线路图(无机试剂任选)__________________。
已知:-OH与碳碳双键两端的碳原子直接相连不稳定,会自变成—CHO。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com