
| v(A) |
| a |
| v(B) |
| b |
| v(D) |
| d |
| v(E) |
| e |
| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/mol?L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/mol?L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/mol?L-1?s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
| A、实验1、2中,v(H2O2)相等 |
| B、将浓度均为0.200mol?L-1 H2O2和HI溶液等体积混合,反应开始时v=0.0304mol?L-1?s-1 |
| C、v与“HI和H2O2浓度的乘积”的比值为常数 |
| D、实验4,反应5秒后H2O2浓度减少了0.0755mol?L-1 |
| v |
| c(HI)?c(H2O2) |
| 0.0076 |
| 0.1×0.1 |
| v |
| c(HI)?c(H2O2) |
| 0.0153 |
| 0.2×0.1 |
| v |
| c(HI)?c(H2O2) |
| 0.0227 |
| 0.3×0.1 |
| v |
| c(HI)?c(H2O2) |
| 0.0151 |
| 0.2×0.1 |


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、丙烯醛的结构简式:CH2CHCHO | ||
B、中子数为16的硫离子:
| ||
| C、硫酸氢钠熔融时的电离方程式:NaHSO4═Na++HSO4- | ||
D、NH4Br的电子式: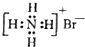 |
查看答案和解析>>
科目:高中化学 来源: 题型:
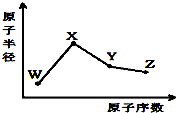 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、对应气态氢化物的稳定性:Y>Z |
| B、化合物XZW既含离子键也含共价键 |
| C、对应简单离子半径:W>X |
| D、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4能从中萃取出碘 |
| B、制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只要将溶液蒸干即可 |
| C、用移液管取液后,将移液管稍倾斜放入垂直的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| D、当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B、用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C、蒸馏水和0.1mol?L-1 NaOH溶液中的c(H+),前者大于后者 |
| D、向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的单质和Q的单质均可用电解法得到 |
| B、X与Z可形成同时含有极性键和非极性键的化合物 |
| C、Q与W形成的化合物熔化或溶于水时均可发生电离 |
| D、X、Y、Z三种元素形成的化合物一定能抑制水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B的气态氢化物稳定性较C的强 |
| B、C与D形成的一种化合物与水反应能产生C2单质 |
| C、均由A、C、D、E四种元素形成的两种盐不能相互反应 |
| D、B的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| B、32gCu与S完全反应转移的电子数为NA |
| C、1L 1.0mol?L-1 NH4Cl与2L 0.5mol?L-1 NH4Cl溶液含NH4+数目相同 |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O→2NaAlO2+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com