
 维生素C是人体维持正常生命过程所必需的一种物质,主要来源于新鲜的蔬菜和水果中,其结构如图.下列关于维生素C的说法中正确的是( )
维生素C是人体维持正常生命过程所必需的一种物质,主要来源于新鲜的蔬菜和水果中,其结构如图.下列关于维生素C的说法中正确的是( )| A、能使FeCl3溶液显紫色 |
| B、难溶于水,易溶于有机溶剂 |
| C、能使溴的四氯化碳溶液褪色 |
| D、能发生加成反应和氧化反应,但不能发生水解反应 |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:
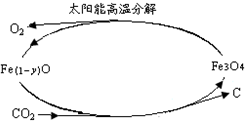 近年来,化学工作者在CO2的应用研究上取得了一些重要成果.
近年来,化学工作者在CO2的应用研究上取得了一些重要成果.| 3 |
| 2 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
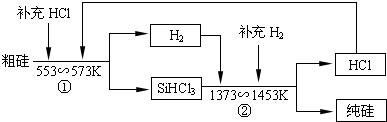
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
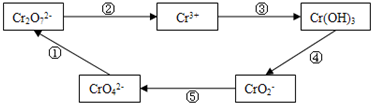
查看答案和解析>>
科目:高中化学 来源: 题型:
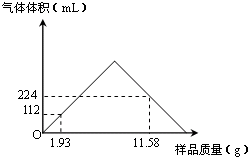 含钡化合物在实验室和工业生产中都有广泛的用途.
含钡化合物在实验室和工业生产中都有广泛的用途.| 500-520℃ |
| 1 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| 高温 |
| 1800℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将浓度为0.1mol?L-1 HF溶液加水不断稀释过程中,c( H+) 和c ( OH-)都会减小 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH.若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量KOH溶液,所得溶液呈中性,该溶液中一定含KHSO3 |
| D、用0.200mol?L-1 NaOH标准溶液滴定浓度均为0.1mol?L-1 的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2、54、24 |
| B、54、2、24 |
| C、32、50、12 |
| D、16、50、24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com