
【题目】铝土矿的主要成分是A12O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取A12O3。

回答下列问题:
(1)沉淀物的化学式分别是:
![]() __________;d__________; f__________;
__________;d__________; f__________;
(2)写出加入过量NaOH溶液时所发生主要反应的离子方程式____________、________
(3)写出通入气体B(过量)时溶液C中发生反应的离子方程式___________、____________。
(4)气体B能否改用试剂A代替?为什么?_________,_________________。
【答案】SiO2 Fe(OH)3 Al(OH)3 Al3++4OH-═AlO2-+2H2O Fe3++3OH-═Fe(OH)3↓ CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- CO2+OH-═HCO3- 不能 生成氢氧化铝能够溶于盐酸
【解析】
SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,沉淀a为二氧化硅,b溶液加入过量氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液c中,气体B为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝;
(1)根据以上推断写出沉淀的化学式;
(2)过量氢氧化钠溶液与铁离子、铝离子反应;
(3)滤液c中含有偏铝酸根离子和过量的氢氧化钠,二氧化碳与偏铝酸根离子生成氢氧化铝沉淀、与氢氧根离子反应生成碳酸氢根离子;
(4)试剂A为盐酸,气体B为二氧化碳,不能够用盐酸代替二氧化碳,根据氢氧化铝能够溶解于盐酸分析。
SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,沉淀a为二氧化硅,b溶液加入过量氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液c中,气体B为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝;
(1)根据分析可知,沉淀a为SiO2,沉淀d为Fe(OH)3,沉淀f为Al(OH)3;
(2)滤液b中含有铁离子和铝离子,加入氢氧化钠溶液反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,Fe3++3OH-═Fe(OH)3↓;
(3)根据流程,滤液c中含有过量的氢氧化钠和偏铝酸根离子,溶液NaAlO2与过量CO2生成Al(OH)3沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,过量二氧化碳与氢氧根离子反应生成碳酸氢根离子,反应的离子方程式为:CO2+OH-═HCO3-;
(4)气体B为二氧化碳,试剂A为盐酸,氢氧化铝能够与过量的盐酸反应而溶解,无法控制加入盐酸的量。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。部分化学键的键能如下表:
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/kJmol-1 | 946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO) (丙容器/span>)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率υ(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是无色无味的气体,它可由氨和氟直接反应得到:4NH3+3F2![]() NF3+3NH4F。下列有关NF3的叙述正确的是
NF3+3NH4F。下列有关NF3的叙述正确的是
A. NF3是离子化合物 B. NF3中的N呈+3价
C. NF3的氧化性比F2强 D. NF3的还原性比NH3强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1mol·L-1HX溶液中逐滴加入0.2mol·L-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是
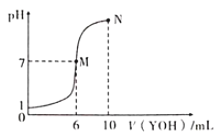
A. HX为一元强酸,YOH为一元弱碱。
B. M点水的电离程度大于N点水的电离程度
C. N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(OH-)>c(H+)
D. 25℃时pH=4的YX溶液中水电离出的c(H+)=1.0×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示:
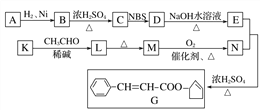
核磁共振氢谱显示A有两种峰,且峰面积之比为1∶1。
已知:CH3CH2CH===CH2![]() CH3CHBrCH===CH2
CH3CHBrCH===CH2
CH3CHO+CH3CHO![]() CH3CHOHCH2CHOCH3CHOHCH2CHO
CH3CHOHCH2CHOCH3CHOHCH2CHO![]() CH3CH===CHCHO+H2O
CH3CH===CHCHO+H2O
请回答下列问题:
(1)A的结简式为__________,G中官能团的名称为___________。
(2)检验M已完全转化为N的实验操作是____________________。
(3)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______________。
(4)写出下列转化的化学方程式,并标出反应类型:
K→L:________________,反应类型:________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有________种。(不考虑立体异构)
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个对位取代基
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)。________
请用以下方式表示:A![]() B…
B…![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图填空。

(1)写出下列各物质的化学式:
A__________,B__________,C__________,
D__________,E__________。
(2)写出生成D的反应方程式_____________________________。
(3)写出E→B的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅( PbSO4) 广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为 PbS, 含有FeS2等杂质)和软锰矿(主要成分为MnO2 ) 制备PbSO4的工艺流程如图:

已知:
i. PbCl2难溶于冷水,易溶于热水
ii. PbCl2 (s) + 2 Cl- ( aq ) ![]() PbCl42-( aq ) △H> 0
PbCl42-( aq ) △H> 0
iii.Ksp(PbSO4) =1. 08 ×10-8 , Ksp(PbC12) = 1. 6× 10 -5
(1)“浸取”过程中盐酸与MnO2 、P bS 发生反应生成PbCl2和S 的化学方程式为______________,加入NaCl 的目的是__________________。
(2)沉降操作时加入冰水的作用是_______________________。
(3) 20°C 时 ,PbCl2 ( s) 在不同浓度盐酸中的最大溶解量( g L-1 ) 如图所示。下列叙述正确的是_____________(填字母)

A. 盐酸浓度越小,Ksp(PbC12)越小
B.x、y 两点对应的溶液中c( Pb2+ )不相等
C 当盐酸浓度为1 mol L-1 时,溶液中c( Pb2+)一定最小
D. 当盐酸浓度小于1 mol L-1时 ,随 HCl 浓度增大,P bCl2 溶解量减少是因为 Cl-浓度增大使 PbCl2溶解平衡逆向移动
(4)调 pH 的目的是__________,PbC12 “转化”后得到 PbSO4, 当c (Cl-)= 0.100mol/L 时 ,c( SO42-) =________________。
(5)滤液 a 经过处理后可以返回到______工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂--三盐基硫酸 (3 PbOPbSO4H2O) ,写出该反应的化学方程式 _____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
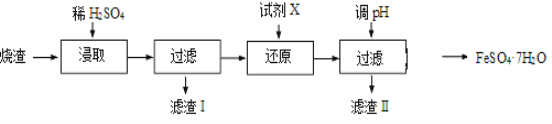
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为__________________。能提高烧渣浸取速率的措施有__________________(填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
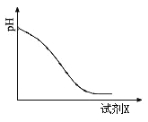
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是________(填字母)。还原结束时,溶液中的主要阴离子有_____________。
A.Fe粉 B.SO2 C.NaI
(3)滤渣Ⅱ主要成分的化学式为__________________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_______________________________ 、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com