
| A. | NH4Br: | B. | CaCl2 | ||
| C. |  | D. |  |
分析 A.铵根离子为复杂阳离子,电子式中需要标出最外层电子;
B.钙离子不需要用中括号,氯离子应该用中括号;
C.漏掉了N的1对未成键电子对;
D.过氧化钠为离子化合物,其化学式中含有2个钠离子和1个过氧根离子,钠离子直接用离子符号表示,过氧根离子需要标出所带电荷及最外层电子.
解答 解:A.NH4Br为离子化合物,铵根离子应该标出最外层电子,其正确的电子式为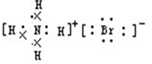 ,故A错误;
,故A错误;
B.CaCl2为离子化合物,阴阳离子需要标出所带电荷,正确的电子式为 ,故B错误;
,故B错误;
C.氮气分子中含有1个氮氮三键,N最外层达到8电子稳定结构,正确的电子式为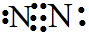 ,故C错误;
,故C错误;
D.过氧化钠为离子化合物,其电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查电子式的表示方法,题目难度不大,明确电子式的概念及书写原则为解答关键,注意掌握离子化合物与共价化合物的电子式区别,试题有利于提高学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅中有少量的氧化铝:加过量的烧碱溶液后过滤 | |
| B. | 乙醇中有水:分液 | |
| C. | Na2CO3溶液(Na2SO4):加入适量Ba(OH)2溶液,过滤 | |
| D. | CO2气体(HCl):通过饱和NaHCO3溶液后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Zn极上发生还原反应 | |
| B. | 电子沿Zn→a→b→Cu路径流动 | |
| C. | 片刻后,乙池中c(Cu2+)减小,c(SO42-)基本不变,溶液不再保持电中性 | |
| D. | 片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| D. | 元素原子的最外层电子数等于元素的最高化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和PCl5的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | 水 | C. | CuSO4(aq) | D. | NaHSO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+11.9kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 根据热化学方程式:S( l )+O2( g )?SO2( g )△H=-293.23kJ/mol分析,1mol SO2的键能的总和大于1mol液态硫和1mol氧气的键能之和 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com