
分析 (1)A液体与金属钠反应放出氢气,说明A 有机物分子中含有羟基;
(2)利用商余法确定B的分子式,根据B、C的性质可知B为烯烃、C为卤代烃,据此确定各物质的结构简式.
解答 解:(1)分子组成为CnH2n+2O 的有机物A与金属钠反应放出氢气,则A有机物分子中含有官能团-OH,名称为羟基,
故答案为:羟基;
(2)在A中加入浓硫酸并加热,生成分子量为42的气态烃B,将B通入溴水中,溴水褪色,生成油状物C,则B分子中含有碳碳双键,为烯烃,C为二溴代烷,
根据$\frac{42}{14}$=3可知B的分子式为C3H6,则B的结构简式为CH2=CH-CH3,B与溴发生加成反应生成C,则C为CH3-CHBr-CH2Br;
A与浓硫酸发生消去反应生成CH2=CH-CH3,则A的结构简式为CH3CH2CH2OH或CH2CH(OH)CH3,
故答案为:CH3CH2CH2OH、CH2CH(OH)CH3;CH2=CH-CH3;CH3-CHBr-CH2Br.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握常见有机物含有的官能团类型及具有的性质,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ/mol) | 390 | 190 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
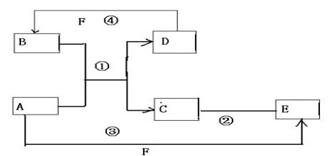
 反应?①的化学方程式2NH3+3Cl2=N2+6HCl
反应?①的化学方程式2NH3+3Cl2=N2+6HCl查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com