
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在透明溶液中:Na+、Cu2+、SO42-、NO3- | |
| C. | 在c(H+)=10-13 mol/L的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
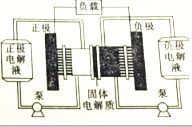 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )| A. | 该电池应该在负极通入空气 | |
| B. | 放电时,Li+透过固体电解质向负极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+2e-═2Cu+O2- | |
| D. | 整个反应过程中,铜相当于催化剂,氧化剂实质是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g HCHO与过量的新制的氢氧化铜悬浊液反应转移了4NA个电子 | |
| B. | 1L 1mol/L 醋酸溶液中分子总数小于NA | |
| C. | 在1mol-CHO中所含电子数为15NA | |
| D. | 1mol CaHxNbOc的有机物中,H最多(2a+b+2)NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCnH2n+2中含有的C-C键数为(n-1)NA | |
| B. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 标准状况下,2.24 L CHCl3的原子总数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
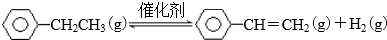
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
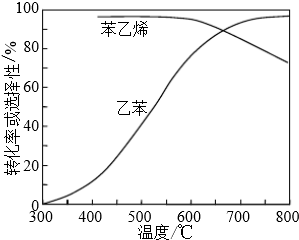
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com