
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
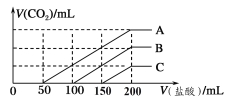
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
【答案】B
【解析】
试题分析:浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,可能发生反应为:2NaOH + CO2 = Na2CO3 + H2O、Na2CO3 + CO2 + H2O = 2NaHCO3,故所得溶液溶质可能为:①NaOH、Na2CO3,②Na2CO3,③Na2CO3、NaHCO3,④NaHCO3;再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,可能发生反应为:NaOH+ HCl = NaCl + H2O, Na2CO3 + HCl = NaHCO3 + NaCl,NaHCO3 + HCl = NaCl + CO2↑ + H2O,由图像可知A曲线前50ml不产生气体,后150ml,产生气体,故A溶液 溶质为③Na2CO3、NaHCO3,故A项错误;B曲线前100ml不产生气体,后100ml产生气体,可知该溶液为②Na2CO3溶液,则可知通入的CO2体积为0.1L×0.2mol/L×22.4L/mol×1000=448ml,故B项正确;由图象可知加入盐酸200ml后反应完毕,则原NaOH溶液的浓度为0.2L×0.2mol/L÷0.1L=0.4 mol/L,故C项错误;C曲线前150ml无气体产生,后50ml产生气体,可知溶液溶质为①NaOH、Na2CO3,可知C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=2:1,故D项错误;本题选B。


科目:高中化学 来源: 题型:
【题目】碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去.某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中 KIO3+5KI+3H2SO4═3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目 , 该反应中还原产物与氧化产物的物质的量比是 , 0.2mol KIO3参加反应时转移电子mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是 ,
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是 , 所用主要玻璃仪器是
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4mL,配制中需要用到的主要玻璃仪器是(填序号) .
A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的化学式:①钡餐:_____。②漂白粉的有效成分_____。
(2)汤姆生发现了电子,提出了____________式的原子结构模型;接触法制硫酸工艺中,在设备_________中发生SO2的催化氧化。
(3)镁燃烧不能用CO2灭火,用化学方程式表示其理由:____________________________________。
(4)写出木炭与浓硫酸共热时发生的化学反应方程式: ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH﹣=IO3﹣+5I﹣+3H2O.下列说法不正确的是( )
A.右侧发生的电极方程式:2H2O+2e﹣=H2↑+2OH﹣
B.电解结束时,右侧溶液中含有IO3﹣
C.电解槽内发生反应的总化学方程式KI+3H2O ![]() KIO3+3H2↑
KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,CH3COOH和NH3H2O的电离常数相等.
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3. ①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为 , 溶液中 ![]() (填“增大”“减小”“不变”或“不能确定”).
(填“增大”“减小”“不变”或“不能确定”).
②25℃时,0.1mol/L氨水(NH3H2O溶液)的pH= . 用pH试纸测定该氨水pH的操作方法为 .
③氨水(NH3H2O溶液)电离平衡常数表达式Kb= , 25℃时,氨水电离平衡常数约为 .
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中 ![]() (填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
当加入CH3COOH溶液体积为10mL时,混合溶液的pH7(填“>”“=”“<”).
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图.已知:pOH=﹣lgc(OH﹣). 
①图中M,Q,N三点所示溶液中水的电离程度最大的是(填字母).
②若Q点时滴加醋酸溶液体积为V2 mL,则V1V2(填“>”“=”“<”).
③若在曲线上某一点W时加入醋酸的体积为V1 mL,则W点应位于图中曲线上Q点的(填“上方”“下方”),此时溶液中离子浓度由大到小的顺序为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com