
高炉炼铁过程中发生的主要反应为1/3Fe2O3(s) + CO(g) 2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=" _________" 、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
| A.减少Fe的量 |
| B.增加Fe203的量 |
| C.移出部分CO2 |
| D.提高反应温度 |
⑴ K=c(CO2)/c(CO) < ⑵ 0.006mol/(L·min) 60℅ ⑶ C
解析试题分析:(1)根据化学平衡常数的定义可知:K=c(CO2)/c(CO)。由于温度升高化学平衡常数。说明升高温度,平衡向逆反应方向移动。逆反应是吸热反应,该反应的正反应为放热反应 △H<0;
(2) 1/3Fe2O3(s) + CO(g)  2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
起: 1 mol 1 mol 1 mol 1 mol
变: 1/3x x 2/3x x
终: 1 mol- 1/3x 1 mol- x 1 mol+ 2/3x 1 mol+ x
平衡常数只与温度有关,且已知1000℃时 K=4.0
即:K=c(CO2)/c(CO)=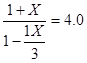 解得:x = 0.6 mol 则υ(CO2)= 0.6 mol/ (10L·l0 min) = 0.006 mol/ (L·min)
解得:x = 0.6 mol 则υ(CO2)= 0.6 mol/ (10L·l0 min) = 0.006 mol/ (L·min)
CO的平衡转化率= 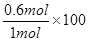 ℅ = 60℅
℅ = 60℅
(3)因Fe和Fe2O3为固体,对平衡没有影响所以A、B错误;C中CO2为气体生成物,减少生成物浓度平衡向正反应方向移动,故C正确;升高温度平衡向吸热反应方向移动。对于该反应来说是向逆反应方向移动,CO的平衡转化率降低。D错误;因为该反应是前后气体相等的可逆反应。所以减小容器的容积也就是增大压强。化学平衡不发生移动。CO的平衡转化率不变。E错误;催化剂只改变化学反应速率而不影响平衡的移动,故F错误。
考点:考查化学平衡常数、化学反应速率的计算及外界条件对反应物的转化率的影响的知识。


科目:高中化学 来源: 题型:填空题
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)??Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):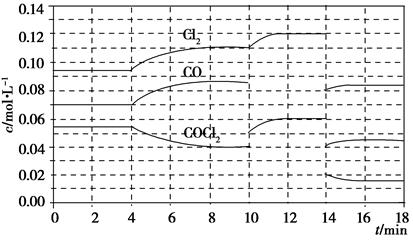
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示的装置中发生反应2A2(g)+B2(g)2C(g);△H=" -a" kJ/mol(a >0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A, B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量 b kJ,B中C的浓度为w2 mol/L,放出热量 c kJ。请回答下列问题:
(1)此反应的平衡常数表达式为______________________;若将温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(2)比较大小:w1_____ w2(填>、=、<),a、b、c由大到小的关系 ______________________。
(3)若打开K,一段时间后重新达平衡,容器B的体积将______________________(填增大,减小或不变)。
(4)若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3 mol/L,则 w1,w3的关系______________________。
(5)能说明A中已达到平衡状态的是 (填序号,有一个或多个选项符合题意)。
a、v(C)=2v(B2)
b、容器内气体压强保持不变
c、容器中气体的平均相对分子质量不随时间而变化
d、容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
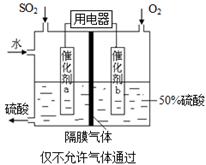
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=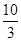 ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
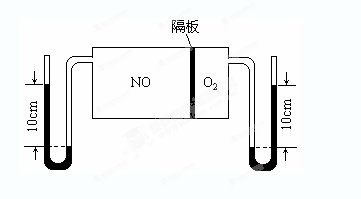
(1)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。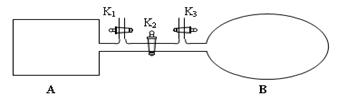
①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
(2)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。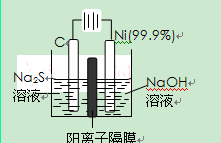
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,
则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在
氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 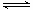 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
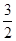 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。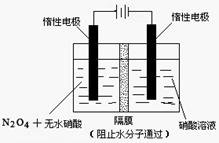
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2+ O2  2NO
2NO
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
 2NH3
2NH3 | 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NO是吸热反应
2NO是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨工业对国民经济和社会发展具有重要的意义。其原理为: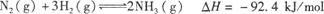 ,据此回答以下问题:
,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。
能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。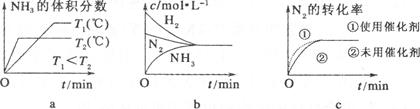
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a b(填“>”、“<”或“=”,下同),Q1 Q2,Q1 92.4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com