
时间 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | a |
c(NO2)/mol·L-1 | 0 | 0.060 | c2 | 0.12 | 0.12 |
试填空:
(1)该反应的化学方程式为__________________;达到平衡时N2O4的转化率为__________,表中c2__________c3__________a(选填“>”“<”或“=”=
(2)20 s时N2O4的物质的量浓度c1=__________mol·L-1,在0—40 s内NO2的平均反应速率为__________mol·L-1·s-1
(3)若在相同情况下最初向该容器充入的是NO2气体,要达到上述同样的平衡状态,NO2的起始浓度是__________mol·L-1
(1)N2O4![]() 2NO2 60% > =
2NO2 60% > =
(2)0.070 0.0025
(3)0.200
解析:(1)2NO2![]() N2O4,达平衡时为60 s以后,c(NO2)=0.12,转c(N2O4)=0.06,转化率为60%,表中c2=0.1,c3=0.04,a=0.04,c2>c3>a
N2O4,达平衡时为60 s以后,c(NO2)=0.12,转c(N2O4)=0.06,转化率为60%,表中c2=0.1,c3=0.04,a=0.04,c2>c3>a
(2)20 s时,c1=0.10 mol·L-1-0.030 mol·L-1=0.070 mol·L-1;0—40 s时:c(NO2)=0.10 mol·L-1
v(NO2)=![]() =0.0025 mol·L-1·s-1
=0.0025 mol·L-1·s-1
(3)恒容状态的有体积变化的反应,等效的前提是必须相同量投料:0.10 mol·L-1 N2O4=0.20 mol·L-1 NO2


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 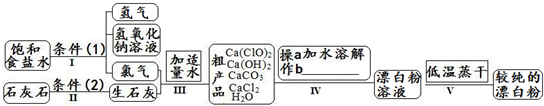 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
查看答案和解析>> 科目:高中化学 来源: 题型: (1)在100℃恒温条件下将0.100mol的N2O4充入体积为1L的真空密闭容器中,发生反应:N2O4(g)?2NO2(g) H>0.隔一定时间对该容器内的物质进行分析,得到如下数据:
①表中a= 0.070 0.070 ,在0~20s内N2O4的平均反应速率为0.0015 0.0015 mol?(L?s)-1.②已知100℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为 b<c1=c2 b<c1=c2 ,c3=0.120 0.120 mol?L-1 ,达到平衡时N2O4的转化率为 60% 60% .(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H2SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H2SiO4(aq)△H ①写出该反应的化学平衡常数K的表达式: K=c(H2SiO4) K=c(H2SiO4) .②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响.在一定温度下,在10000m以下的地球深处,上述反应的方向是 正方向 正方向 (填“正方向”、“逆方向”或“不移动”),理由是由于固体和液体对会受到大压强的影响,所以K=
由于固体和液体对会受到大压强的影响,所以K= .
查看答案和解析>> 科目:高中化学 来源: 题型: 配制一定物质的量浓度的溶液是实验室进行科学研究的重要环节。 (1)若配制大约1 mol·L-1的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是__________(选填字母序号)。 A.氢氧化钠固体 B.浓硫酸(98%) C.浓盐酸(37%) D.浓硝酸(63%) (2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。
该步操作对所得溶液浓度的影响是__________(填“偏高”“偏低”或“无影响”),原因是_______ _____________________________________________________________________。 (3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?_______ ____________________________________________________________________。 (4)现用移液管准确量取20.0 mL 0.100 mol·L-1的碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2—3滴,此时溶液呈__________色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成__________色时即达到滴定终点,此时消耗盐酸体积为21.36 mL,则待测盐酸的浓度为__________ mol·L-1。 查看答案和解析>> 科目:高中化学 来源:2013-2014学年江西省吉安市高三上学期期末教学质量评价化学试卷(解析版) 题型:填空题 开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。 (1)甲烷水蒸气转化法制H2的主要转化反应如下: CH4(g) + H2O(g) CH4(g) + 2H2O(g) 上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是??????? 。 (2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g) ①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );
②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________ a.容器内气体密度恒定?? b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2 c.容器的压强恒定?????? d.3v正(CH4) = v逆(H2) (3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等 B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L C.②点时,溶液中的c(F-)=c(Na+) D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L (4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为????????????????????? 。
查看答案和解析>> 科目:高中化学 来源:2013-2014学年湖北省荆州市毕业班质量检查(一)化学试卷(解析版) 题型:填空题 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g) (1)2NH3(g) ①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变 A.①③④ B.①②④⑤ C.①④⑤ D.②③④ (2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。 ②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_ (填“增大”、“不变”或“减小”)。 ③上述可逆反应的平衡常数为_ (保留二位小数)。 ④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是 (填图甲中的“A”或“B”)。
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,若两极共收集到气体22. 4L(标 况),则消耗的尿素为 g(忽略气体的溶解)。
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |