
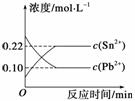
 25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
科目:高中化学 来源: 题型:
一种从植物中提取的天然化合物α﹣damascone可用于制作香水,其结构为: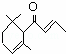 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A. 分子式为C13H20O
B. 该化合物可发生聚合反应
C. 1mol该化合物完全燃烧消耗19 mol O2
D. 与Br2的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中盛有HI气体,在400℃时建立如下平衡:2HI(g)⇌H2 (g)+I2 (g);△H>0,改变下列条件,请填空:(填写变化情况)
(1)将温度升至480℃,混合气体的颜色 ,(加深,变浅、不变)HI的分解率 ,(增大、减小、不变),化学平衡向 移动,平衡常数 (增大、减小、不变),混合气体的总质量 (增大、减小、不变);
(2)若将密闭容器的体积压缩了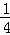 ,平衡常数 (增大、减小、不变)
,平衡常数 (增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法错误的是 ( )
A. NA 个OH-  含有电子10mol
含有电子10mol
B.某元素R一个原子的质量是ag,则其的相对原子质量可表示为a NA,
C.4L0.5mol/L的NaOH溶液中含有阴离子的数目为2NA
D.配制一定物质的量浓度的 NaOH溶液时,定容时俯视操作所得溶液浓度偏低
NaOH溶液时,定容时俯视操作所得溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃ 20 mL 3 mol·L-1的X溶液
B.20℃ 30 mL 2 mol·L-1的X溶液
C.20℃ 10 mL 4 mol·L-1的X溶液
D.10℃ 10 mL 2 mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①可以判断该分解反应已经达到平衡的是________(填字母序号)。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时的分解平衡常数:____________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH____0(填“>”、“=”或“<”),熵变ΔS____0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2ONH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如下图所示。
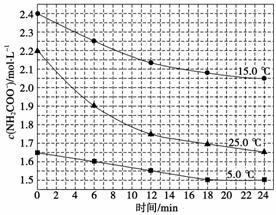
①计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:__________。
②根据图中信息,如何说明该水解反应速率随温度升高而增大:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将3molN2和3molH2充入一个容积固定的密闭容器中,发生反应N2(气)+3H2(气)⇌2NH3(气).当反应达到平衡时NH3为nmol.在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中不正确的是( )
| 起始状态/mol |
| ||
| N2 | H2 | NH3 | |
| A | 2 | 0 | 2 |
| B | 2.5 | 1.5 | 1 |
| C | 2 | ||
| D | 0 | 0 | 2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
铝合金是制造飞机、汽车等的常用材料.下列关子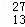 Al的叙述正确的是( )
Al的叙述正确的是( )
A. 质子数是27 B. 中子数是27 C. 电子数是13 D. 质量数是13
查看答案和解析>>
科目:高中化学 来源: 题型:
“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液
②是胶体
③能产生丁达尔效应
④能透过滤纸
⑤不能透过滤纸
⑥静置后,会析出黑色沉淀.
|
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com