
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A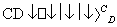 B(在水溶液中进行)
B(在水溶液中进行)
其中C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式________;D的电子式_______ _。
_。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为____________;由A转化为B的离子方程式为_____________________________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:________________________________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是__________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有_______________________________。
解析:本题考查物质结构、元素周期律及化学方程式的书写等,意在考查考生的分析推理能力。首先根据题意可推出五种元素依次是H、C、O、Na、Al。(1)根据“同周期元素从左向右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大”即可解答。(2)五种元素形成的气体溶于水呈酸性,则C只能是CO2,淡黄色固体D只能是Na2O2。①根据信息可知B是Al(OH)3,在水溶液中Na2O2与水反应生成NaOH,再与Al(OH)3反应生成NaAlO2,故A是NaAlO2。将CO2通入NaAlO2溶液中,若CO2过量生成NaHCO3,若CO2不足则生成Na2CO3。②易推出A是Na2CO3,B是NaHCO3。等物质的量浓度的Na2CO3与NaHCO3的混合溶液中,c(Na+)最大;由于CO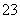 的水解程度大于HCO
的水解程度大于HCO 且前者水解生成后者,所以c(HCO
且前者水解生成后者,所以c(HCO )>c(CO
)>c(CO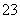 );溶液呈碱性则必有c(OH-)>c(H+);又由于OH-和H+均来自弱电解质的电离或水解,其浓度很小,则有c(Na+)>c(HCO
);溶液呈碱性则必有c(OH-)>c(H+);又由于OH-和H+均来自弱电解质的电离或水解,其浓度很小,则有c(Na+)>c(HCO )>c(CO
)>c(CO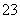 )>c(OH-)>c(H+)。向该溶液中滴加盐酸,发生反应:Na2CO3+HCl===NaHCO3+NaCl,NaHCO3+HCl===NaCl+H2O
)>c(OH-)>c(H+)。向该溶液中滴加盐酸,发生反应:Na2CO3+HCl===NaHCO3+NaCl,NaHCO3+HCl===NaCl+H2O +CO2↑,少量二氧化碳溶于水使溶液呈酸性,所以当溶液呈中性时,应有少量NaHCO3剩余,因此溶质的主要成分是NaHCO3、NaCl和CO2(或H2CO3)。
+CO2↑,少量二氧化碳溶于水使溶液呈酸性,所以当溶液呈中性时,应有少量NaHCO3剩余,因此溶质的主要成分是NaHCO3、NaCl和CO2(或H2CO3)。
答案:(1)Na>Al>C>O>H
(2)O===C===O Na+[∶O∶,∶∶O∶,∶∶]2-Na+
①NaAlO2 AlO +2H2O+CO2===Al(OH)3↓+HCO
+2H2O+CO2===Al(OH)3↓+HCO (或2AlO
(或2AlO +3H2O+CO2===2Al(OH)3↓+CO
+3H2O+CO2===2Al(OH)3↓+CO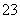 )
)
②CO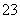 +H2OHCO
+H2OHCO +OH- c(Na+)>c(HCO
+OH- c(Na+)>c(HCO )>c(CO
)>c(CO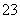 )>c(OH-)>c(H+) NaCl、NaHCO3、CO2(或H2CO3)
)>c(OH-)>c(H+) NaCl、NaHCO3、CO2(或H2CO3)


科目:高中化学 来源: 题型:
有下列各组微粒或物质:
A.O2和O3
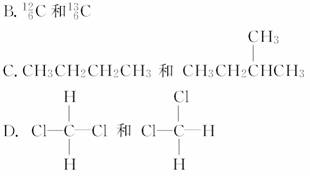
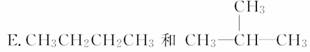
(1)________组两种微粒互为同位素。
(2)________组两种物质互为同素异形体。
(3)________组两种物质属于同系物。
(4)________组两物质互为同分异构体。
(5)________组两物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
做好环境消毒工作是预防“禽流感”的重要措施,常用的一种消毒剂是ClO2,实验室可通过以下反应制得ClO2(未配平):KClO3+H2C2O4+H2SO4―→ClO2↑+K2SO4+CO2↑+H2O。下列说法正确的是( )
A.H2SO4在反应中作氧化剂
B.ClO2是还原产物
C.H2C2O4在反应中被氧化
D.1 mol KClO3参加反应时有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生命金属”之称。下列有关 Ti和
Ti和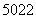 Ti的说法中正确的是( )
Ti的说法中正确的是( )
A. Ti和
Ti和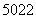 Ti中均含有22个中子
Ti中均含有22个中子
B. Ti和
Ti和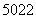 Ti核外均有4个电子层
Ti核外均有4个电子层
C.分别由 Ti和
Ti和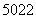 Ti组成的金属钛单质互称为同分异构体
Ti组成的金属钛单质互称为同分异构体
D. Ti和
Ti和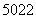 Ti的性质完全相同
Ti的性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是 ( )
| 元素性质 | 元素编号 | ||||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | 无 | -3 | -1 | 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.气态氢化物的稳定性①>②
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)===H2O(l);ΔH= -57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量为57.3 kJ
C.由C(石墨)―→C(金刚石);ΔH=+73 kJ/mol,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l);ΔH=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
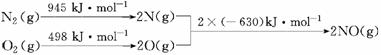
写出该反应的热化学方程式:________________。
(2)(2013·全国新课标)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)===CH3OH(g)ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)===CH3OH(g)+H2O(g)ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)===CO2(g)+H2(g)ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)===CH3OCH3(g)+H2O(g)ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________。
根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按系统命名法填写下列有机物的名称及有关内容。
(1)  名称是________。
名称是________。
(2) 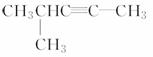 分子式为________。名称是________,1 mol该烃完全燃烧耗O2________mol。
分子式为________。名称是________,1 mol该烃完全燃烧耗O2________mol。
(3)分子式为C4H8的所有烯烃(不包括顺反异构)的结构简式及名称_________________________________________________________。
(4) 名称是________。
名称是________。
(5)新戊烷以系统命名法命名为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com