
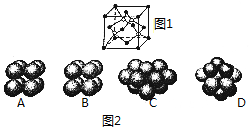
 (1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同
(1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同分析 (1)由图2可知,碳原子为面心立方堆积,为ABC型堆积;
(2)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用;根据均摊法计算晶胞中C、Si原子数目,进而计算晶胞中含有C、Si原子总体积,计算晶胞的体积,晶胞的空间利用率=$\frac{晶胞中C、Si原子总体积}{晶胞体积}$×100%.
解答 解:(1)由图2可知,碳原子为面心立方堆积,为ABC型堆积,选项D符合,
故答案为:D;
(2)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用,故与碳原子距离最近且相等的碳原子有12个;
算晶胞中C原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、Si原子数目=4,晶胞边长为a cm,则晶胞体积为a3cm3,碳原子直径为b cm,则晶胞中C原子总体积=4×$\frac{4}{3}$×π×($\frac{b}{2}$)3cm3=$\frac{2}{3}$πb3cm3,硅原子直径为c cm,则晶胞中Si原子总体积=4×$\frac{4}{3}$×π×($\frac{c}{2}$)3cm3=$\frac{2}{3}$πc3cm3,故晶胞中C、Si原子总体积=$\frac{2}{3}$πb3cm3+$\frac{2}{3}$πc3cm3=$\frac{2}{3}$π(b3+c3)cm3,故晶胞的空间利用率=$\frac{\frac{2}{3}π({b}^{3}+{c}^{3})c{m}^{3}}{3{a}^{3}c{m}^{3}}$×100%=$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%,
故答案为:$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.
点评 本题考查晶胞计算,题目难度较大,明确常见晶胞结构为解答关键,注意掌握均摊法在晶胞计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杜绝铝制品在生产生活中的应用 | |
| B. | 不能用铝制器皿长期存放酸性或碱性食品 | |
| C. | 不吃或少吃使用了含铝食品添加剂的食物 | |
| D. | 氢氧化铝可用于药物治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
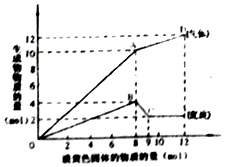 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )| A. | 溶液中一定含有Mg2+、NH4+、Al3+,可能含有Fe2+ | |
| B. | 图中A点产生的气体总质量为230克 | |
| C. | 图中A到D之间会产生有刺激性气味的气体 | |
| D. | 图中B到C之间发生的化学反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
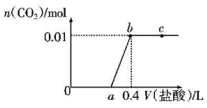 向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )
向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )| A. | a点时溶液中存在c(Na+)=c(HCO3-)+C(CO32-)+c(H2CO3) | |
| B. | 0~a段溶液中水电离出的OH-浓度先增大后减小 | |
| C. | a=0.2 | |
| D. | ab段发生反应的离子方程式为CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合后溶液呈酸性,则:c(HSO3-)>c(SO32-) | |
| B. | 0.1mol•L-1的CH3COONa溶液20mL与0.1mol•L-1的稀盐酸10mL混合后溶液显酸性:c(CH3COO-)>c (Cl-)>c(H+)>c(CH3COOH) | |
| C. | c(NH4+)浓度相同的NH4Cl、(NH4)2SO4、(NH4)2CO3溶液中,溶质的物质的量浓度:c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl) | |
| D. | 0.1mol•L-1NaNO3溶液与0.1mol•L-1CH3COOH溶液以任意比例混合:c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com