
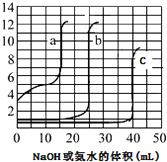
 取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )| A. | 由图可知曲线c为NaOH滴定硫酸 | |
| B. | 由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度 | |
| C. | 曲线b、c的滴定实验可用酚酞做指示剂 | |
| D. | 由图可知滴定前醋酸电离度约为1.67% |
分析 由图象可知加入NaOH或氨水时,a的pH在开始阶段变化较大,应为碱滴定弱酸的变化曲线,则b、c为硫酸、盐酸的滴定曲线,由于浓度未知,则不能确定b、c,如用氨水中和,滴定终点时溶液呈酸性,应用甲基橙为指示剂,结合消耗氢氧化钠的物质的量计算醋酸的浓度,结合pH计算电离度.
解答 解:A.由图象可知加入NaOH或氨水时,a的pH在开始阶段变化较大,应为碱滴定弱酸的变化曲线,则b、c为硫酸、盐酸的滴定曲线,由于浓度未知,则不能确定b、c,故A错误;
B.硫酸、盐酸都为强酸,题中纵坐标为pH,不能确定浓度大小,故B错误;
C.如用氨水中和,滴定终点时溶液呈酸性,应用甲基橙为指示剂,故C错误;
D.开始时醋酸溶液pH=3,c(H+)=10-3mol/L,滴定终点时消耗NaOH的体积为15mL,则有c(HAc)×0.025L=0.10mol/L×0.015L,c(HAc)=0.06mol/L,醋酸电离度为$\frac{0.001}{0.06}×100%$=1.67%,故D正确.
故选D.
点评 本题考查酸碱混合的定性判断和计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握题目图象的分析和弱电解质的电离特点,难度中等.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 四种物质中分别加入氯水,均有红棕色液体生成 | |
| B. | 四种物质中加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| C. | 四种物质中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| D. | 乙发生消去反应得到两种烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H12 | 3 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2,能与NaHCO3反应 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | |
| C | D | E |
| A. | 原子半径:C<D<E | |
| B. | 金属性:A>C | |
| C. | 氢氧化物的化学式及其碱性:COH>D(OH)2>E(OH)3 | |
| D. | 最外层电子数:A>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com