

分析 装置A为乙醇燃料电池,若通电5min时,铜电极质量增加21.6g,所以Cu是阴极,Ag是阳极,②是正极,①是负极,Fe是阴极,石墨是阳极,燃料电池中,燃料通入负极,氧气通入正极,根据电解池的工作原理以及电极反应式结合电子转移知识进行计算即可.
(1)燃料电池中,燃料通入负极,氧气通入正极;
(2)D中石墨是阳极,发生氧化反应;
(3)乙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,根据电极反应式结合电子守恒以及电解质复原的方法:出什么加什么,出多少加多少来回答.
(4)阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,调换正负极继续电解,此时阳极上金属铜溶解,转移电子0.5mol,金属铜全部溶解,然后是2H2O-4e-=O2↑+4H+,根据电子守恒来计算.
解答 解:装置A为乙醇燃料电池,若通电5min时,铜电极质量增加21.6g,所以Cu是阴极,Ag是阳极,②是正极,①是负极,Fe是阴极,石墨是阳极,
(1)A中乙醇应从负极①处通入,在乙醇燃料电池中,负极上是燃料乙醇发生失电子的氧化反应,在碱性环境下,电极反应为:C2H6O+16OH--12e-=2CO32-+11H2O;
故答案为:①;C2H6O+16OH--12e-=2CO32-+11H2O;
(2)D中石墨是阳极,电极反应式为:2Cl--2e-═Cl2↑,故答案为:2Cl--2e-═Cl2↑;
(3)乙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,2L1.0mol/L的CuSO4溶液中铜离子物质的量是:2mol,铜离子得电子的是4mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+4=4n,解得n=2,即装置在转移电子的物质的量是2mol,乙醇燃料电池的负极上发生反应:C2H6O+16OH--12e-=2CO32-+11H2O,当转移电子是2mol,消耗乙醇的物质的量是$\frac{1}{6}$mol,质量是$\frac{1}{6}$mol×46g/mol=7.7g,复原C中溶液应加入Cu(OH)2
,根据铜元素守恒,加入的物质的量是2mol,质量是2mol×98g/mol=196g,
故答案为:7.7;Cu(OH)2;196.
(4)阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,当电路中通过0.5mol电子后,阳极上消耗氢氧根离子0.25mol,阴极上析出金属铜0.25mol,调换正负极继续电解,此时阳极上金属铜溶解,转移电子0.5mol,金属铜全部溶解,然后是2H2O-4e-=O2↑+4H+,转移0.5mol电子消耗氢氧根离子是0.25mol,阴极上发生反应:Cu2++2e-=Cu,电路中再通过1.0mol电子,消耗铜离子是0.5mol,所以此时溶液中c(H+)为$\frac{0.5mol}{2L}$=0.25mol/L,故答案为:0.25mol/L.
点评 本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在NaHSO4溶液中加Ba(OH)2至中性:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$=BaSO4↓+2H2O | |
| B. | 向硫酸铜溶液中通入H2S气体:Cu2++H2S═CuS↓+2H+ | |
| C. | SO2气体通入Ba(OH)2溶液中:SO2+2OH-═SO${\;}_{3}^{2-}$ | |
| D. | 用稀硫酸酸化硫化钠和亚硫酸钠的混合溶液:SO${\;}_{3}^{2-}$+2S2-+6H+═3S↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Ba2+、HCO3-、NO3-、K+ | |
| B. | 能使紫色石蕊试剂变红的溶液中:NH4+、NO3-、CO32-、Na+ | |
| C. | 使酚酞试液变红的溶液:Na+、Ca2+、NO3-、Cl- | |
| D. | 有SO42-存在的溶液中:K+、Ba2+、Ag+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
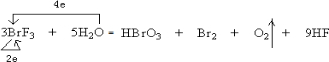 ,还原剂是H2O和BrF3,氧化剂是BrF3.氧化产物是HBrO3、O2. 还原产物是Br2(以上均填化学式)
,还原剂是H2O和BrF3,氧化剂是BrF3.氧化产物是HBrO3、O2. 还原产物是Br2(以上均填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Fe3+、K+、OH-、NO3- | |
| B. | 能使石蕊试剂变红的溶液:SO42-、Cl-、Cu2+、NH4+ | |
| C. | 强碱性溶液中:K+、Ca2+、Cl-、HCO3- | |
| D. | 强酸性溶液中:Na+、Fe2+、Cl-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业是指电解熔融氯化钠制取氯气的方法 | |
| B. | 氯碱工业只能得到氯气和氢氧化钠两种有价值的产品 | |
| C. | 实验室模拟氯碱工业制取氯气后所得溶液呈碱性 | |
| D. | 实验室模拟氯碱工业所得氯气不能直接排放,应用澄清石灰水吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 其名称是2,4-二甲基-3-乙基-己烷.
其名称是2,4-二甲基-3-乙基-己烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com