
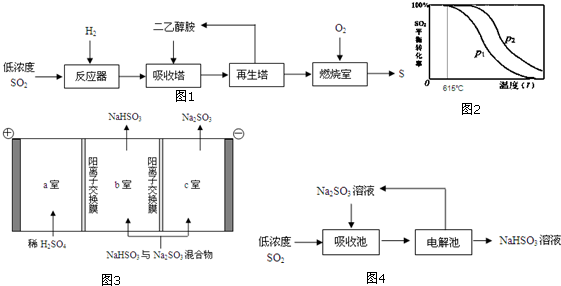
·ÖĪö £Ø1£©¢Ł·Ö×Ó¾§ĢåµÄĪČ¶ØŠŌÓėÖŠŠÄŌ×ӵķĒ½šŹōŠŌÓŠ¹Ų£¬Ķ¬Ö÷×åŌŖĖŲ£¬“ÓÉĻµ½ĻĀ£¬Ō×Ó°ė¾¶Öš½„Ōö“ó£¬µĆµē×ÓÄÜĮ¦¼õČõ£¬·Ē½šŹōŠŌ¼õČõ£»
¢ŚĘ½ŗā³£ŹżÖøø÷Éś³ÉĪļÅØ¶ČµÄ»Æѧ¼ĘĮæŹż“ĪĆŻµÄ³Ė»ż³żŅŌø÷·“Ó¦ĪļÅØ¶ČµÄ»Æѧ¼ĘĮæŹż“ĪĆŻµÄ³Ė»żĖłµĆµÄ±ČÖµ£¬»ÆŃ§Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬3H2£Øg£©+SO2£Øg£©?H2S£Øg£©+2H2O£Øg£©£¬Ėę×ÅĪĀ¶ČµÄÉżøߣ¬¶žŃõ»ÆĮņµÄĘ½ŗā×Ŗ»ÆĀŹ¼õŠ”£¬»ÆŃ§Ę½ŗā³£ŹżKµÄ±ä»ÆĒ÷ŹĘŹĒ¼õŠ”£¬±Č½ĻP1ŗĶP2µÄ“󊔹ŲĻµ£¬Ščµ±ĪĀ¶ČŅ»¶ØŹ±½ųŠŠ±Č½Ļ£»
£Ø2£©¹¤ŅµÉĻĻČÓƶžŅŅ“¼°·ĪüŹÕH2S£¬Č»ŗóŌŚŌŁÉśĖžÖŠ¼ÓČČ·Ö½āÖŲŠĀ»ńµĆH2S£¬Ö÷ŅŖÄæµÄŹĒČ„³żŌÓÖŹ£¬»ńµĆøßÅضČH2S£»
£Ø3£©øł¾ŻČČ»Æѧ·½³ĢŹ½ŹéŠ“·½·ØŠ“³öČČ»Æѧ·½³ĢŹ½£¬±ź×¢ĪļÖŹ¾Ū¼ÆדĢ¬ŗĶ¶ŌÓ¦·“Ó¦µÄģŹ±ä£»
£Ø4£©Na2SO3Ė®ČÜŅŗĪüŹÕSO2Éś³ÉĖįŹ½ŃĪNaHSO3£»
£Ø5£©µē½ā·ØæÉ·ÖĄėNaHSO3ÓėNa2SO3»ģŗĻĪļ£¬Ńō¼«·¢ÉśŃõ»Æ·“Ó¦£¬Ź§Č„µē×ÓÉś³ÉŃõĘų£¬ĒāĄė×ÓŗĶŃĒĮņĖįøłĄė×Ó·“Ӧɜ³ÉŃĒĮņĖįĒāøłĄė×Ó£¬Ņõ¼«·¢Éś»¹Ō·“Ӧɜ³ÉĒāĘų£¬µ¼ÖĀHSO3-?H++SO32-ÕżĻņŅĘ¶Æ£¬NaHSO3×Ŗ»ÆĪŖNa2SO3£®
½ā“š ½ā£ŗ£Ø1£©¢ŁŃõŗĶĮņŌŖĖŲ“¦ÓŚĶ¬Ö÷×壬“ÓÉĻµ½ĻĀ£¬Ō×Ó°ė¾¶Öš½„Ōö“ó£¬µĆµē×ÓÄÜĮ¦¼õČõ£¬·Ē½šŹōŠŌ¼õČõ£¬ĖłŅŌĪČ¶ØŠŌ£ŗH2O£¾H2S£¬
¹Ź“š°øĪŖ£ŗČõ£»ŃõŗĶĮņŌŖĖŲ“¦ÓŚĶ¬Ö÷×壬“ÓÉĻµ½ĻĀ£¬Ō×Ó°ė¾¶Öš½„Ōö“ó£¬µĆµē×ÓÄÜĮ¦¼õČõ£»
¢Ś3H2£Øg£©+SO2£Øg£©?H2S£Øg£©+2H2O£Øg£©£¬¶žŃõ»ÆĮņĪŖ·“Ó¦Īļ£¬Ķ¼Ź¾Ń¹ĒæŅ»¶Ø£¬ĖęĪĀ¶ČÉżøߣ¬¶žŃõ»ÆĮņµÄĘ½ŗā×Ŗ»ÆĀŹ¼õŠ”£¬ĖłŅŌ»ÆŃ§Ę½ŗā³£ŹżKµÄ±ä»ÆĒ÷ŹĘŹĒ¼õŠ”£¬µ±ĪĀ¶ČŅ»¶ØŹ±£¬Ōö“óŃ¹Ēæ3H2£Øg£©+SO2£Øg£©?H2S£Øg£©+2H2O£Øg£©Ę½ŗāÕżĻņŅĘ¶Æ£¬SO2µÄ×Ŗ»ÆĀŹŌö“󣬓ÓĶ¼Ź¾æÉÖŖ£¬Ķ¬ĪĀ¶ČĻĀ£¬P2µÄSO2µÄ×Ŗ»ÆĀŹŌö“ó£¬ĖłŅŌP2£¾P1£¬
¹Ź“š°øĪŖ£ŗ¼õŠ”£»P2£¾P1£»µ±ĪĀ¶ČŅ»¶ØŹ±£¬Ōö“óŃ¹Ēæ3H2£Øg£©+SO2£Øg£©?H2S£Øg£©+2H2O£Øg£©Ę½ŗāÕżĻņŅĘ¶Æ£¬SO2µÄ×Ŗ»ÆĀŹŌö“ó£»
£Ø2£©Éś³ÉµÄĮņ»ÆĒāĘųĢåÖŠŗ¬ÓŠĖ®ÕōĘų£¬¶žŅŅ“¼°·ÄÜĪüŹÕH2S£¬²»ĪüŹÕĖ®ÕōĘų£¬Č»ŗóŌŚŌŁÉśĖžÖŠ¼ÓČČ·Ö½āÖŲŠĀ»ńµĆH2S£¬Ö÷ŅŖÄæµÄŹĒø»¼ÆH2S£Ø»ńµĆøßÅضČH2S£©£¬
¹Ź“š°øĪŖ£ŗø»¼ÆH2S£Ø»ńµĆøßÅضČH2S£©£»
£Ø3£©1mol H2SĘųĢåĶźČ«Č¼ÉÕÉś³É¹ĢĢ¬Įņ»Ē¼°ĘųĢ¬Ė®£¬ŹĶ·Åa kJÄÜĮ棬2mol H2SĘųĢåĶźČ«Č¼ÉÕÉś³É¹ĢĢ¬Įņ»Ē¼°ĘųĢ¬Ė®£¬ŹĶ·Å2akJÄÜĮ棬·ÅČČ£¬”÷H£¼0£¬ĖłŅŌĘäČČ»Æѧ·½³ĢŹ½ĪŖ2H2S£Øg£©+O2£Øg£©=2S£Øs£©+2H2O£Øg£©”÷H=-2akJ/mol£¬
¹Ź“š°øĪŖ£ŗ2H2S£Øg£©+O2£Øg£©=2S£Øs£©+2H2O£Øg£©”÷H=-2akJ/mol£»
£Ø4£©Na2SO3Ė®ČÜŅŗĪüŹÕSO2Éś³ÉNaHSO3£¬·“Ó¦ĪŖNa2SO3+SO2+H2O=2NaHSO3£¬¹Ź“š°øĪŖ£ŗNa2SO3+SO2+H2O=2NaHSO3£»
£Ø5£©Ķعżµē½ā·ØæÉ·ÖĄėNaHSO3ÓėNa2SO3»ģŗĻĪļ£¬Ńō¼«2H2O-4e-=4H++O2”ü£¬c£ØH+£©Ōö“ó£¬H+ÓÉaŹŅ¾ŃōĄė×Ó½»»»Ä¤½ųČėbŹŅ£¬H+ÓėSO32-½įŗĻÉś³ÉHSO3-£¬Na2SO3×Ŗ»ÆĪŖNaHSO3£®Ņõ¼«2H++2e-=H2”ü£¬µ¼ÖĀHSO3-?H++SO32-ÕżĻņŅĘ¶Æ£¬Na+“ÓbŹŅ½ųČėcŹŅ£¬NaHSO3×Ŗ»ÆĪŖNa2SO3£¬ŹµĻÖNa2SO3µÄŃ»·ĄūÓĆ£¬
¹Ź“š°øĪŖ£ŗŃō¼«2H2O-4e-=4H++O2”ü£¬c£ØH+£©Ōö“ó£¬H+ÓÉaŹŅ¾ŃōĄė×Ó½»»»Ä¤½ųČėbŹŅ£¬H+ÓėSO32-½įŗĻÉś³ÉHSO3-£¬Na2SO3×Ŗ»ÆĪŖNaHSO3£®Ņõ¼«2H+-2e-=H2”ü£¬µ¼ÖĀHSO3-?H++SO32-ÕżĻņŅĘ¶Æ£¬Na+“ÓbŹŅ½ųČėcŹŅ£¬NaHSO3×Ŗ»ÆĪŖNa2SO3£®
µćĘĄ ±¾Ģāæ¼²éĮĖÓŠ¹Ų¶žŃõ»ÆĮņµÄŠŌÖŹ£¬Éę¼°»ÆŃ§Ę½ŗā”¢·“Ó¦ČČµÄ¼ĘĖć”¢µē½āÓŠ¹ŲÖŖŹ¶£¬øł¾ŻĢāøÉŠÅĻ¢½įŗĻÓŠ¹ŲÖŖŹ¶½ā“š£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
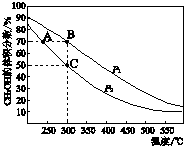 CH3OHŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬¹¤ŅµÉĻÓĆCOÓėH2ŌŚ“߻ƼĮ×÷ÓĆĻĀŗĻ³ÉCH3OH£¬Ęä·“Ó¦ĪŖ£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©£®°“n£ØCO£©£ŗn£ØH2£©=1£ŗ2ĻņĆܱÕČŻĘ÷ÖŠ³äČė·“Ó¦Īļ£¬²āµĆĘ½ŗāŹ±»ģŗĻĪļÖŠCH3OHµÄĢå»ż·ÖŹżŌŚ²»Ķ¬Ń¹ĒæĻĀĖęĪĀ¶ČµÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ£Ø””””£©
CH3OHŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬¹¤ŅµÉĻÓĆCOÓėH2ŌŚ“߻ƼĮ×÷ÓĆĻĀŗĻ³ÉCH3OH£¬Ęä·“Ó¦ĪŖ£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©£®°“n£ØCO£©£ŗn£ØH2£©=1£ŗ2ĻņĆܱÕČŻĘ÷ÖŠ³äČė·“Ó¦Īļ£¬²āµĆĘ½ŗāŹ±»ģŗĻĪļÖŠCH3OHµÄĢå»ż·ÖŹżŌŚ²»Ķ¬Ń¹ĒæĻĀĖęĪĀ¶ČµÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ£Ø””””£©| A£® | P1£¼P2 | B£® | øĆ·“Ó¦µÄ”÷H£¾0 | ||
| C£® | Ę½ŗā³£Źż£ŗK£ØA£©=K£ØB£© | D£® | ŌŚCµćŹ±£¬CO×Ŗ»ÆĀŹĪŖ75% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĖįŠŌĒæČõ£ŗHIO4£¼HBrO4£¼HClO4 | B£® | Ō×Ó°ė¾¶“󊔣ŗNa£¾O£¾S | ||
| C£® | ¼īŠŌĒæČõ£ŗKOH£¾NaOH£¾LiOH | D£® | ½šŹōŠŌĒæČõ£ŗNa£¾Mg£¾Al |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
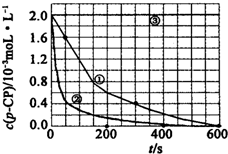 £ØŅ»£©Fenton·Ø³£ÓĆÓŚ“¦Ąķŗ¬ÓŠÄŃ½µ½āÓŠ»śĪļµÄ¹¤Ņµ·ĻĖ®£¬Ķس£ŹĒŌŚµ÷½ŚŗĆpHŗĶFe2+ÅØ¶ČµÄ·ĻĖ®ÖŠ¼ÓČėH2O2£¬Ėł²śÉśµÄōĒ»ł×ŌÓÉ»łÄÜŃõ»Æ½µ½āĪŪČ¾Īļ£®ĻÖŌĖÓĆøĆ·½·Ø½µ½āÓŠ»śĪŪČ¾Īļp-CP£¬Ģ½¾æÓŠ¹ŲŅņĖŲ¶ŌøĆ½µ½ā·“Ó¦ĖŁĀŹµÄÓ°Ļģ£®ŹµŃéÖŠæŲÖĘp-CPµÄ³õŹ¼ÅضČĻąĶ¬£¬ŗć¶ØŹµŃéĪĀ¶ČŌŚ298K»ņ313KĻĀÉč¼ĘČēĻĀ¶Ō±ČŹµŃé£ØĘäÓąŹµŃéĢõ¼ž¼ūĻĀ±ķ£©£ŗ
£ØŅ»£©Fenton·Ø³£ÓĆÓŚ“¦Ąķŗ¬ÓŠÄŃ½µ½āÓŠ»śĪļµÄ¹¤Ņµ·ĻĖ®£¬Ķس£ŹĒŌŚµ÷½ŚŗĆpHŗĶFe2+ÅØ¶ČµÄ·ĻĖ®ÖŠ¼ÓČėH2O2£¬Ėł²śÉśµÄōĒ»ł×ŌÓÉ»łÄÜŃõ»Æ½µ½āĪŪČ¾Īļ£®ĻÖŌĖÓĆøĆ·½·Ø½µ½āÓŠ»śĪŪČ¾Īļp-CP£¬Ģ½¾æÓŠ¹ŲŅņĖŲ¶ŌøĆ½µ½ā·“Ó¦ĖŁĀŹµÄÓ°Ļģ£®ŹµŃéÖŠæŲÖĘp-CPµÄ³õŹ¼ÅضČĻąĶ¬£¬ŗć¶ØŹµŃéĪĀ¶ČŌŚ298K»ņ313KĻĀÉč¼ĘČēĻĀ¶Ō±ČŹµŃé£ØĘäÓąŹµŃéĢõ¼ž¼ūĻĀ±ķ£©£ŗ| ŹµŃéŠņŗÅ | ŹµŃéÄæµÄ | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ¢Ł | ĪŖŅŌĻĀŹµŃé×÷²ĪÕÕĪļ | 298 | 3 | 6.0 | 0.30 |
| ¢Ś | Ģ½¾æĪĀ¶Č¶Ō½µ½ā·“Ó¦ĖŁĀŹµÄÓ°Ļģ | 313 | 3 | 6.0 | 0.30 |
| ¢Ū | 298 | 10 | 6.0 | 0.30 | |
| c£ØI-£©/£Ømol•L-1£© | c£ØFe3+£©/£Ømol•L-1£© | v/£Ømol•L-1•s-1£© | |
| £Ø1£© | 0.20 | 0.80 | 0.032k |
| £Ø2£© | 0.60 | 0.40 | 0.144k |
| £Ø3£© | 0.80 | 0.20 | 0.128k |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| ŹŌ¹ÜA | ŹŌ¹ÜB | |
| ¼ÓČėŹŌ¼Į | ||
| ŹµŃéĻÖĻó£ØĶŹÉ«Ź±¼ä£© | ||
| ½įĀŪ | ²ĀĻė¢ņÕżČ· | |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com