
| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| C. | 二氧化锰具有氧化性,既能氧化浓盐酸制氯气,也能将双氧水氧化为氧气 | |
| D. | 氮的氧化物是形成光化学烟雾的主要物质 |
分析 A.溶解N、S的氧化物的雨水为酸雨;
B.常温下Al与浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生;
C.二氧化锰可催化双氧水的分解;
D.氮的氧化物有毒,为常见的空气污染物.
解答 解:A.正常雨水的pH约为5.6,而溶解N、S的氧化物的雨水为酸雨,酸雨的pH<5.6,故A错误;
B.常温下Al与浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,则用铝制容器存放浓硝酸,故B错误;
C.二氧化锰可催化双氧水的分解,而二氧化锰具有氧化性,既能氧化浓盐酸制氯气,故C错误;
D.氮的氧化物有毒,为常见的空气污染物,是形成光化学烟雾的主要物质,故D正确;
故选D.
点评 本题考查三废处理及环境保护,为高频考点,把握环境污染物、环境污染问题、物质的性质及反应为解答的关键,侧重分析与应用能力的考查,注意化学与生活、环境的联系,题目难度不大.


科目:高中化学 来源: 题型:实验题
 甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| B. | 1 mol CnH2n+2分子中含共价键数目为(3n+1)NA | |
| C. | 含NA个氧原子的O2与含NA个氧原子的O3的质量比为2:3 | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
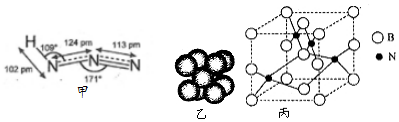
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+的结构示意图: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | H2O2的电子式: | |
| D. | 小苏打的电离方程式:NaHCO3?Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与盐酸发生中和反应 OH-+H+═H2O | |
| B. | 氢氧化钡溶液与硫酸溶液发生中和反应 2OH-+2H+═2H2O | |
| C. | 稀盐酸滴在大理石上 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向氯化钠溶液中滴加硝酸银溶液 Cl-+Ag+═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
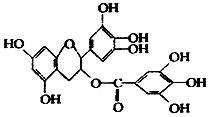 美国梅奥诊所的研究人员发现,绿茶中含有 EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知 EGCG 的结构式如图,有关 EGCG 的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有 EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知 EGCG 的结构式如图,有关 EGCG 的说法错误的是( )| A. | EGCG 的分子式为 C22H18O11 | |
| B. | EGCG 在空气中易氧化,其分子中含有 3 个手性碳原子 | |
| C. | 1molEGCG 最多可与含 9mol 氢氧化钠的溶液完全作用 | |
| D. | EGCG 能与碳酸钠溶液反应,还能和甲醛反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com