
在下图中,横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量:
从A~D中选择符合表中各项要求填入相应位置。
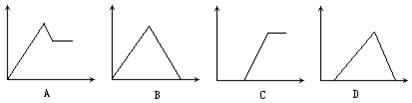
BCDAC</PGN0098B.TXT/PGN>
①饱和石灰水中通入二氧化碳,立即生成沉淀,当通入过量二氧化碳时,沉淀逐渐溶解,当通入二氧化碳跟原溶液中氢氧化钙的物质的量比为2∶1时,沉淀完全溶解,反应的化学方程式是:
Ca(OH)2+CO2====CaCO3↓+H2O
CaCO3+CO2+H2O====Ca(HCO3)2
②二氧化碳通入含氢氧化钠的偏铝酸钠溶液中,首先跟氢氧化钠反应,没有沉淀生成:
2NaOH+CO2====Na2CO3+H2O
把氢氧化钠都中和完以后,接着二氧化碳跟偏铝酸钠反应:
NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3
当偏铝酸钠反应完以后,再通入二氧化碳,沉淀不再增加,但是也不会溶解。
③稀盐酸加到含氢氧化钠的偏铝酸钠溶液中时,首先中和氢氧化钠,没有沉淀生成:
NaOH+HCl====NaCl+H2O
然后盐酸跟偏铝酸钠反应,生成沉淀,加入过量的盐酸时,生成的氢氧化铝沉淀又溶解于盐酸中:
NaAlO2+HCl+H2O====Al(OH)3↓+NaCl
Al(OH)3+3HCl====AlCl3+3H2O
④氢氧化钠逐滴加到氯化镁和氯化铝的混合溶液中,观察到有白色沉淀生成,沉淀逐渐增加:
MgCl2+2NaOH====Mg(OH)2↓+2NaCl
AlCl3+3NaOH====Al(OH)3↓+3NaCl
当溶液中的Mg2+、Al3+都用完时,沉淀量最大,再加过量的氢氧化钠溶液,沉淀开始减少,到氢氧化铝全部溶解时,沉淀的量不再减少:
Al(OH)3+NaOH====NaAlO2+2H2O
⑤三氯化铝溶液逐滴加氢氧化钠溶液时,先观察到有白色沉淀,由于氢氧化钠过量,振荡,沉淀溶解,直至氢氧化钠消耗尽:
AlCl3+3NaOH====Al(OH)3↓+3NaCl
Al(OH)3+NaOH====NaAlO2+2H2O
继续滴加三氯化铝,有白色沉淀生成,沉淀量不断增加,当溶液中AlO2-离子消耗尽以后,再加三氯化铝,沉淀的量不变。
3NaAlO2+AlCl3+6H2O====4Al(OH)3↓


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:江苏省南海中学2008届高三化学第一次月考试题 题型:022
某学生为了测定某稀硫酸的物质的量浓度,用不同质量的纯锌粉与该硫酸进行反应.他的六次实验结果如下(计算结果精确到0.1):
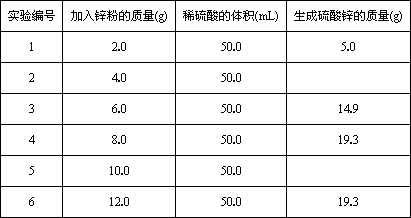
(1)第2、第5组两实验中生成硫酸锌的质量分别是________g和________g.
(2)请在下图中画出生成硫酸锌的质量[m(ZnSO4)]与加入锌粉的质量[m(Zn)]的关系图(需要标明关键点的横坐标和纵坐标).
(3)若使(10+m)g锌粉与50.0 mL上述稀硫酸充分反应,剩余固体的质量为________g;该稀硫酸的物质的量浓度为________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) |
|
|
|
|
|
|
|
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) |
|
|
|
|
|
|
|
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
查看答案和解析>>
科目:高中化学 来源:2011-2012学年新疆兵团二中高三第一次月考化学试卷 题型:填空题
(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.

回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
|
c(HCl) |
|
|
|
|
|
|
|
|
(mol/L) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
103 c(PbCl2) |
|
|
|
|
|
|
|
|
(mol/L) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com