
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O $\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2↑ | D. | Cl2+2NaOH═NaCl+NaClO+H2O |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B物质的量浓度 | B. | 混合气体的密度 | ||
| C. | 混合气体的压强 | D. | 混合气体的平均相对分子量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40 g NaOH溶解于1 L水中,得到1 mol•L-1的NaOH溶液 | |
| B. | 将11.2 L HCl气体通入水配成0.5 L的溶液,浓度为1 mol•L-1 | |
| C. | 将1 L 10 mol•L-1的盐酸与9 L水混合,混合液浓度为1 mol•L-1 | |
| D. | 10 g NaOH溶解在水中配成250 mL溶液,其浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
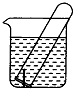 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用等量的金属钠分别与水和乙醇反应 |
| B | 检验溴乙烷中含有溴元素 | 先加NaOH溶液共热,然后加入AgNO3溶液 |
| C | 证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液 |
| D | 除去苯中的少量苯酚 | 加入过量浓溴水,振荡后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
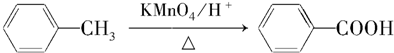

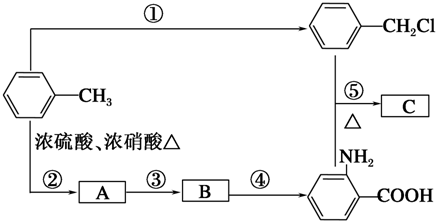
 、A物质的结构简式是
、A物质的结构简式是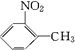 .
.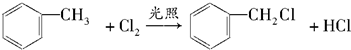 ,取代反应
,取代反应 ,取代反应.
,取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 甲 | 乙 | 丙 | 试管中现象 |
| A | 浓氨水 | 生石灰 | Al(SO4)3溶液 | 先沉淀后消失 |
| B | 浓硝酸 | 铜 | 淀粉KI溶液 | 试管口出现红棕色溶液仍为无色 |
| C | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
| D | 双氧水 | 二氧化锰 | 氢硫酸 | 溶液出现浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com