
【题目】(1)p电子的原子轨道呈______形;
(2)共价键的类型有两种分别是σ键和π键,σ键的对称方式为______;
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是______,最高价氧化物对应的水化物的化学式______;
(4)用“>”或“<”填空:①能量:4p______5s②离子半径:F-______Na+;
(5)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
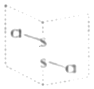
①S2Cl2的结构式为______,其化学键类型有______(填“极性键”“非极性键”或“极性键和非极性键”)。
②电负性:S______Cl(填“>”或“<”),每个S原子有______对弧电子对。
【答案】哑铃 轴对称 As H3AsO4 < > Cl-S-S-Cl 极性键和非极性键 < 2
【解析】
(1)p电子的原子轨道呈哑铃型;
(2)σ键以“头碰头”的方式发生轨道重叠,轨道重叠部分是沿着键轴呈圆柱形分布的;
(3)位于元素周期表中第四周期,第VA族的元素为As元素,据此解答;
(4)根据能级交错现象分析判断;电子层数相同的核电荷数越大,离子半径越小;
(5)①根据S2Cl2的空间结构书写结构式,结合共价键的分类分析解答;
②元素的非金属性越强,电负性越强;根据硫的原子结构结合S2Cl2的结构式判断S的孤对电子对数。
(1)p电子的原子轨道呈哑铃型,三维空间分别为px、py、pz,故答案为:哑铃;
(2)σ键以“头碰头”的方式发生轨道重叠,轨道重叠部分是沿着键轴对称,故答案为:轴对称;
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是As,最高价氧化物对应的水化物的化学式H3AsO4,故答案为:As;H3AsO4;
(4)①根据能级交错现象,能量:4p<5s;②相同电子层数的离子,核电荷数越大离子半径越小:F->Na+,故答案为:<;>;
(5)①根据S2Cl2的空间结构可知,其结构式为Cl-S-S-Cl,含有极性键Cl-S和非极性键S-S键,故答案为:Cl-S-S-Cl;极性键和非极性键;
②元素吸电子能力越强,非金属性越强,其电负性越强,非金属性S<Cl,电负性S<Cl;S2Cl2的结构式为Cl-S-S-Cl,硫原子最外层有6个电子,形成了2个σ键,还含有2对孤对电子对,故答案为:<;2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
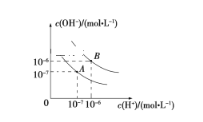
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________,cH+==__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____。
(5)在曲线B对应的温度下,将pH=2的某HA溶液和pH=10的NaOH溶液等体积混合,所得溶液的pH=5。请分析其原因:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年,我省爆发了新型冠状病毒肺炎疫情,严重影响了人民的健康。茚地那韦或对新型肺炎有治疗效果。茚地那韦的结构简式如图所示。下列有关茚地那韦的说法正确的是
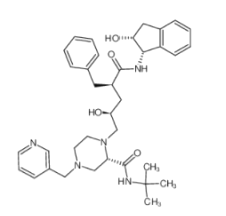
A.分子中含氧官能团有羟基和羧基B.苯环上的一溴代物只有五种
C.可以发生取代反应和加成反应D.该分子属于合成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前手机屏幕主要由保护玻璃、触控层以及下面的液晶显示屏三部分组成。下面是工业上用丙烯(A)和有机物C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:

(1)化合物C的官能团名称为____________________。B的结构简式为_____________。
(2)反应①的反应类型为_____________。
(3)写出C与过量NaHCO3水溶液反应的化学方程式______________________________。
(4)下列关于化合物D的说法正确的是__________(填字母)。
A.属于烯烃B.1molD最多能与4molH2发生加成反应
C.一定条件下发生缩聚反应D.核磁共振氢谱有6组峰
(5)满足下列条件下的D的同分异构体有多种,写出2个互为顺反异构的结构简式。顺式结构:_______________,反式结构_______________。
①能发生银镜反应和水解反应②存在手性碳原子
(6)请参照上述制备流程,写出以有机物C、乙烯和![]() 为原料制备
为原料制备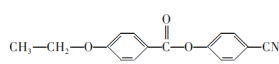 的合成路线流程图(无机试剂任用)___。
的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )
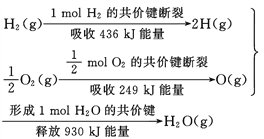
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+![]() O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是________(填字母)。
O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是________(填字母)。

a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5 mol CH3OH和2 mol O2充入2 L的密闭容器中,经过4 min反应达到平衡,测得c(O2)=0.2 mol·L-1,4 min内平均反应速率v(H2)=________,则CH3OH的转化率为_______________。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是________(填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
(4)写出CH3OH燃料电池在酸性条件下负极的反应式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)=C(金刚石)ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)![]() 2H2O(l) ΔH=+285.8 kJ·mol-1
2H2O(l) ΔH=+285.8 kJ·mol-1
D. 在稀溶液中:H++OH-![]() H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法、吸收法或电解法处理SO2。利用催化还原 SO2法 不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)已知CH4和S的燃烧热(△H)分别为-890.3 kJ/ mol和一297.2 kJ/ mol , 则CH4 催化还原SO2反应:CH4(g) +2 SO2 (g) =CO2(g)+ 2S(s)+ 2 H2O(1) △H =_____kJ/mol
(2)在恒容密闭容器中,用 H2还原SO2生成S 的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示 :
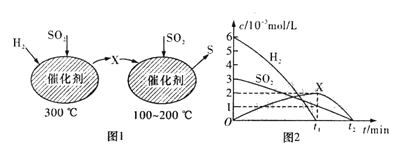
分析可知X为_______(填化学式),o~t1时间段的温度为_______,o~ t1时间段用SO2表示的化学反应速率为______________。
(3)焦炭催化还原SO2生成S2, 化学方程式为2C(s)+ 2 SO2 (g)![]() S2(g)+2CO2(g)△H < 0。
S2(g)+2CO2(g)△H < 0。
实验测得:v正= k 正c2 (SO2 ) , v逆= k 逆c(S2 ) c2 ( CO 2) ( k正、k逆为速率常数,只与温度有关).某温度下,向2L的恒容密闭容器中充入lmol SO2,并加入足量焦炭,当反应达平衡时,SO2 转化率为80%,则:
①k正:k 逆=_______________。
②若升高温度,k正增大的倍数______( 填“> ”、“< ”或“= ”) k 逆增大的倍数。
(4) 利用如图所示装置(电极均为惰性电极)可吸收SO2。
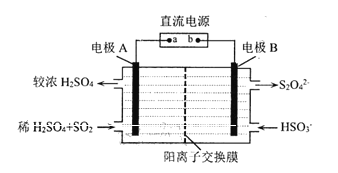
直流电源a为_______极,电解时.电极B的电极反应式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com