
【题目】下列物质中属于原子晶体的化合物是
A.金刚石B.食盐C.二氧化硅D.干冰
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室制备溴乙烷(C2H5Br)的方法为:
NaBr + H2SO4 = NaHSO4 + HBr
C2H5OH + HBr ![]() C2H5Br + H2O
C2H5Br + H2O
其中可能会发生副反应:
2HBr + H2SO4(浓) = Br2 ↑+ SO2↑ + 2H2O
制取的装置和步骤如图(已知溴乙烷的沸点38.4℃,不溶于水):
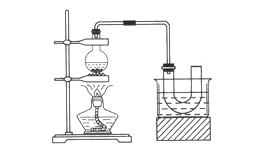
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热.使其充分反应.
请根据信息回答下列问题:
(1)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为___________,同时生成的无色气体分子式为________________。
(2)为了更好的控制温度,除用图示的小火加热外,更好的加热方式为________。
(3)反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________________________(填序号)。
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行__________(填操作名称)。
(4)下列几项实验步骤,为了检验溴乙烷中溴元素,取出少量溴乙烷产品,而后正确的操作顺序是:___________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH水溶液;⑤冷却
A. ④①⑤③② B. ④③①⑤② C. ④③②①⑤ D. ④②①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是

A.电池A极区的电极反应式为:H2O2+2e-=2OH-
B.电池放电过程中,Na+从负极区向正极区移动
C.每有1mol NaBH4参加反应转移电子数为4NA
D.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及氮的化合物在生产生活中有着重要的用途,NH3、HNQ3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C+ O2→2CO
②C+H2O(g)→CO+H2
③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=_______m3,实际消耗了_____kg焦炭。
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(1) ΔH<0。若向2L 恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
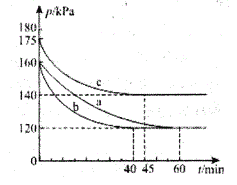
①与实验a相比,c组改变的实验条件可能是____________。
②用P0表示开始时总压强,P表示平衡时总压强,.用α表示SO2的平衡转化率,则α表达式为________。
(3)已知N2O4![]() 2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2
2NO2,N2O4与NO2共存的温度是264-413K,低于溶点264K时,全部为无色的N2O4 晶体,达到264K时N2O4开始分解,沸点294K时成为红棕色的混合气体,温度高与413K时,气体又变为无色。(2NO2![]() 2NO+O2 )。在1L的密闭容器中发生反应N2O4
2NO+O2 )。在1L的密闭容器中发生反应N2O4![]() 2NO2达到平衡状态。
2NO2达到平衡状态。
①若此时为标准状态下(273K 101KPa),再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色____(和原平衡状态比,填选项字母,下同)
A.增大(加深) B.减小(变浅) C.不变 D.不能确定
②若此时为25℃,101KPa下,再向其中加入4.6g纯的NO2,则达到平衡时混合物的颜色______,混合物中NO2的体积分数___________。
(4)查阅资料可知:常温下,Ksp[Ag(NH3)2-]= 1.00×107。Ksp[AgC1]=2.50×10-10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=__________;
②计算得到可逆反应AgCl (s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=______,1 L 1 mol/L氨水中最多可以溶解AgCl_______mol(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的化学式:
①臭氧_______________;
②小苏打________________。
(2)写出镁条在二氧化碳气体中燃烧的化学方程式__________________________________________。
(3)写出实验室用足量的烧碱溶液吸收氯气的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol·L-1Ba(OH)2溶液300mL,反应后溶液中SO42﹣的物质的量浓度为( )
A. 0.4mol·L-1 B. 0.3mol·L-1 C. 0.2mol·L-1 D. 0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
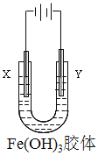
【题目】胶体是一种常见的分散系,回答下列问题。
(1)向大量沸腾的蒸馏水中逐滴加入___________溶液,继续煮沸至________________________________,停止加热,可制得Fe(OH)3胶体;
(2)向Fe(OH)3胶体中滴加氢碘酸(HI水溶液)至过量,观察到的现象为________________________________________,该反应的离子方程式为________________________________________________________;
(3)如由图所示,通电后,Fe(OH)3胶体粒子向_________电极移动(填“X”或“Y”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(22Ti)、铁(26Fe)及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_____________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有_________种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_____________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C![]() N)和异硫氰酸(H-N=C=S)。
N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒______________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为______________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是__________________________________。
(4)TiCl3可用作烯烃定向聚合的催化剂,如:nCH3CH=CH2![]() 。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
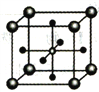
(5)Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+处于立方体的中心)。该晶体中,Ti4+和周围________个O2-紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为________cm(用含NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com