
 常温下,0.2mol•L-1NaHA 与等浓度等体积的 NaOH 溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA 与等浓度等体积的 NaOH 溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | NaHA 溶液显酸性 | B. | 混合溶液中 c(OH-)、c(H+)相等 | ||
| C. | 图中 X、Y、Z 分别代表 OH-、HA-、H+ | D. | 混合溶液中:c(Na+)═c(H2A)+c(HA-)+c(A2-) |
分析 NaHA和NaOH溶液等体积、等浓度0.2mol/L混合,发生反应NaHA+NaOH=Na2A+H2O,所得溶液中A2-浓度小于0.1mol/L,说明在溶液中存在A2-+H2O?HA-+OH-,A2-水解,Na2A溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(A-)>c(OH-)>c(HA-)>c(H+),即X表示OH-,Y表示HA-,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA).
A.NaHA为弱酸的酸式盐溶液可能显酸性,也可能显碱性;
B.该溶液中酸根离子两步水解导致溶液呈碱性;
C.X表示OH-,Y表示HA-,Z表示H+;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:NaHA和NaOH溶液等体积、等浓度0.2mol/L混合,发生反应NaHA+NaOH=Na2A+H2O,所得溶液中A2-浓度小于0.1mol/L,说明在溶液中存在A2-+H2O?HA-+OH-,A2-水解,Na2A溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(A-)>c(OH-)>c(HA-)>c(H+),即X表示OH-,Y表示HA-,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA).
A.NaHA为弱酸的酸式盐溶液,溶液中存在水解平衡和电离平衡,若电离程度大于水解程度,则显酸性,若水解程度大于电离程度,则显碱性,故A错误;
B.该混合液酸根离子两步水解导致溶液呈碱性,则c(OH-)>c(H+),故B错误;
C.由分析可知,X表示OH-,Y表示HA-,Z表示H+,故C正确;
D.混合后发生反应为NaHA+NaOH=Na2A+H2O,则c(Na)=2c(A),即C(Na+)=2C(H2A)+2C(HA-)+2C(A2-),故D错误.
故选C.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,为高频考点,明确溶液中溶质成分及其性质是解本题关键,注意物料守恒的正确应用,题目难度不大.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题

| A. | 两个实验均表现了NH3易溶于水 | |
| B. | 两个实验均表现了NH3易挥发 | |
| C. | 两个实验均表现了NH3是碱性气体 | |
| D. | 两个实验均表现了NH3是还原性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个电化学过程的示意图.
如图是一个电化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO32-、I-、Ca2+ | B. | Ca2+、I-、MnO4-、SO32- | ||
| C. | Ca2+、CO32-、I-、SO32- | D. | NH4+、Br-、CO32-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A. | 等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等 | |
| B. | 完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等 | |
| C. | 一定条件下,两种物质都能发生酯化反应和氧化反应 | |
| D. | 鞣酸分子中,可能在同一平面上的原子最多有14个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
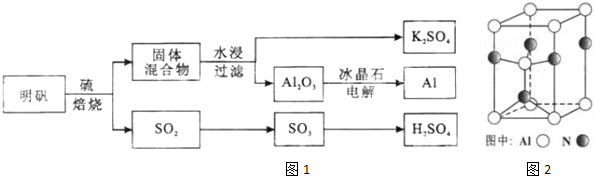
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子 | 键长(1.0×10-10m) | 键能(kJ•mol-1) |
| O22- | 1.49 | a |
| O2- | 1.28 | b |
| O2 | 1.21 | c=494 |
| O2+ | 1.12 | d=628 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
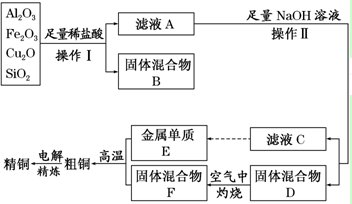
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com