
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式 。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为 个、 个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为 、 (各写一种)。
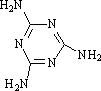
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。

三聚氰胺分子中氮原子轨道杂化类型是 , 1 mol三聚氰胺分子中 σ键的数目为 。
(1)1s22s22p63s23p63d54s2(1分) (2)6(1分) 12 (1分)
(3)CO2(或N2O、CS2、BeCl2等合理均可) (1分) N3-(1分)
(4)sp2、sp3(2分,全对得分) 15NA(1分)
【解析】
试题分析: (1)Mn为25号元素,根据电子排布规律可得电子排布式。
(2)观察CoTiO3晶体结构模型图,可知1个Ti原子周围距离最近的O原子数目分别为6个、1个Co原子周围距离最近的O原子数目为12个。
(3)等电子体为原子数目相等、价电子数相等。
(4)-NH2中N形成了三个单键为SP3杂化,环中的形成了一个单键和一个双键,为SP2杂化,1个三聚氰胺分子含15个σ键,所以1 mol三聚氰胺分子中 σ键的数目为15NA。
考点:本题考查电子排布式的书写、配位数、等电子体和杂化轨道。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:江苏省某重点中学2012届高三10月月考化学试题 题型:058
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
(1)
写出基态Mn原子的核外电子排布式________.(2)CoTiO3晶体结构模型如图.在CoTiO3晶体中1个Ti原子、1个Co原子周围距离最近的O数目分别为________个、________个.
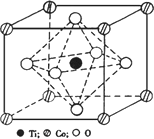
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理.O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2.与CNO-互为等电子体的分子、离子化学式分别为________、________(各写一种).
(4)三聚氰胺是一种含氮化合物,其结构简式如图.三聚氰胺分子中氮原子轨道杂化类型是________;1 mol三聚氰胺分子中σ键的数目为________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)
(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ====2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向 (填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为 。
②加入MnS的目的是除去 杂质。
查看答案和解析>>
科目:高中化学 来源:2010年天津市高三第五次月考(理综)化学部分 题型:填空题
(14分)
(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ==== 2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向 (填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥–0.42 |
≥2.5 |
≥7 |
≥7 |
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为 。
②加入MnS的目的是除去 杂质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com