
分析 检验SO42-常选用试剂氯化钡溶液和盐酸,观察是否产生不溶于酸的白色沉淀--硫酸钡.但是检验SO42-常会受到Ag+的干扰,因为当向待测溶液中滴加氯化钡溶液,如果待测溶液中存在Ag+,同样会产生一种不溶于酸的白色沉淀氯化银.
因此,在检验SO42-的过程中,为了排除Ag+的干扰,常先往溶液中滴加适量稀盐酸无现象后,再滴加氯化钡溶液,以此来解答.
解答 解:(1)乙认为甲的实验不严谨,因为试样A中若含有Ag+,它会和氯化钡溶液中的Cl-反应,产生不溶于酸的白色沉淀AgCl,
故答案为:Ag+;
(2)丙认为乙的实验也不严谨,因为试样B中若含有SO32-,加稀硝酸后,SO32-被硝酸氧化为SO42-,所以原溶液中可能没有SO42-,
故答案为:SO32-;
(3)为了排除Ag+和SO32-对SO42-检验的干扰,可以先往试样中滴加稀盐酸,如果无沉淀和气体生成,说明不存在Ag+和SO32-,再滴入氯化钡溶液,产生白色沉淀,则沉淀一定是硫酸钡,原试样中存在SO42-,则试剂I为盐酸,I中现象为无沉淀和气体生成,试剂II为BaCl2,II中现象为生成白色沉淀,
故答案为:盐酸;无沉淀和气体生成;BaCl2;生成白色沉淀.
点评 本题考查实验评价及常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意离子检验时排除干扰离子的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
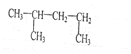
| A. | ②⑤⑥ | B. | ②④ | C. | ④⑤ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向或向避风的沟塘低洼处转移 | |
| B. | 要快速地将翻落的氯槽罐安全起吊移到水池,进行碱液稀释中和 | |
| C. | 液氯流淌速度很慢,居民不必惊慌,可以放心退到家中,关紧门窗 | |
| D. | 检修或现场抢救时,没有防毒面具,可以佩戴用浓碱溶液浸过的湿口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
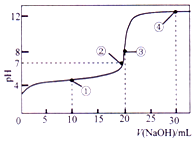 常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 点③所示溶液中:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 点④所示溶液中:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
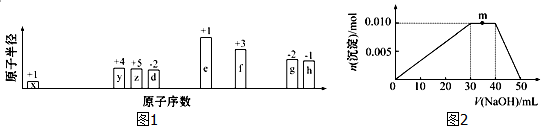
 (或
(或
 ).
).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水防止食品变质 | |
| C. | 采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体 | |
| D. | 中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏可用于分离提纯液态有机混合物 | |
| B. | 乙烯和甲烷可用酸性KMnO4溶液鉴别 | |
| C. | 甲烷和氯气发生取代反应需要光照 | |
| D. | 核磁共振氢谱通常用于分析有机物的相对分子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com