
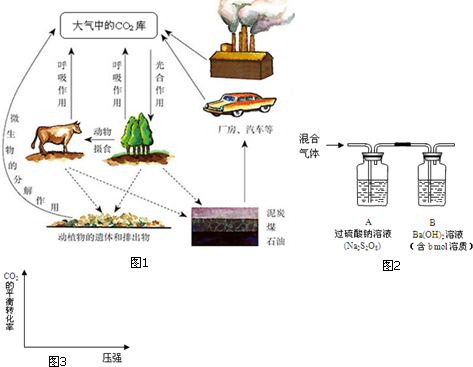
·ÖĪö £Ø1£©A£®¹ż¶ČÅÅ·ÅCO2ŠĪ³ÉĪĀŹŅŠ§Ó¦£¬SO2ŗĶNO2ĘųĢå¹ż¶ČÅÅ·ÅŠĪ³ÉĖįÓź£»
B£®ĀĢÉ«Ö²ĪļĶعż¹āŗĻ×÷ÓĆÖĘŌģµÄÓŠ»śĪļ£¬²»½öĀś×ćĮĖ×ŌÉķÉś³¤”¢·¢Óż”¢·±Ö³µÄŠčŅŖ£¬¶ųĒŅĪŖÉśĪļȦ֊µÄĘäĖūÉśĪļĢį¹©ĮĖ»ł±¾µÄŹ³ĪļĄ“Ō“”¢ŃõĘųĄ“Ō“”¢ÄÜĮæĄ“Ō“£®ĀĢÉ«Ö²ĪļĶعż¹āŗĻ×÷ÓĆĻūŗÄ“óĘųÖŠµÄ¶žŃõ»ÆĢ¼£¬ŹĶ·ÅŃõĘų£Ø³¬¹żĮĖ×ŌÉķ¶ŌŃõµÄŠčŅŖ£©£¬Ī¬³ÖÉśĪļȦ֊µÄ¶žŃõ»ÆĢ¼ŗĶŃõĘųµÄĻą¶ŌĘ½ŗā£»
C£®ŹÆÓĶŹĒĶ¦µÄ»ģŗĻĪļ£¬ĆŗŹĒÓÉÓŠ»śĪļŗĶĪŽ»śĪļ×é³ÉµÄø“ŌӵĻģŗĻĪļ£»
D£®ÉśĪļȦ֊µÄĢ¼Ń»·Ö÷ŅŖ±ķĻÖŌŚĀĢÉ«Ö²Īļ“ÓæÕĘųÖŠĪüŹÕ¶žŃõ»ÆĢ¼£¬¾¹āŗĻ×÷ÓĆ×Ŗ»ÆĪŖĘĻĢŃĢĒ£¬²¢·Å³öŃõĘų£¬»¹Éę¼°ŗ¬Ģ¼µÄ»ÆŗĻĪļÖ®¼äæÉŅŌĻą»„×Ŗ»Æ£¬ČēĢ¼ĖįµÄŠĪ³É”¢Ģ¼ĖįµÄ·Ö½ā”¢Ģ¼ĖįøĘŗĶĢ¼ĖįĒāøĘÖ®¼äµÄ×Ŗ»ÆµČ£»
£Ø2£©¶ÆĪļĶعżŗōĪü×÷ÓĆ½«ĘĻĢŃĢĒ×Ŗ»ÆĪŖCO2µÄ·“Ó¦ĪŖĘĻĢŃĢĒŗĶŃõĘųŌŚĆø×÷ÓĆĻĀ·“Ӧɜ³É¶žŃõ»ÆĢ¼ŗĶĖ®£¬Ō×ÓŹŲŗćÅäĘ½ŹéŠ“»Æѧ·½³ĢŹ½£»
£Ø3£©¢Ł²ā¶ØĆŗ»ņŹÆÓĶµÄŗ¬Ģ¼Įæ£ŗ½«a gµÄѳʷ½ųŠŠ³ä·ÖČ¼ÉÕ£¬²ā¶ØĖłµĆĘųĢå£ØCO2”¢SO2”¢NO2”¢N2£©ÖŠCO2µÄŗ¬Į棬¹żĮņĖįÄĘČÜŅŗ¾ßÓŠŃõ»ÆŠŌæÉŅŌÓÅ»Ż¶žŃõ»ÆĮņĪŖĮņĖį£¬Ńõ»ÆŅ»Ńõ»ÆµŖĪŖĻõĖį£»
¢ŚŃé½įŹųŗ󣬻¹ŠčŅŖĻņ×°ÖĆÖŠĶØČėN2£¬°ŃÉś³ÉµÄ¶žŃõ»ÆĢ¼ĘųĢåČ«²æøĻČė×°ÖĆBÖŠĶźČ«ĪüŹÕ£»
¢ŪÓĆx mol/L HClČÜŅŗµĪ¶Ø×°ÖĆBÖŠ¹żĮæµÄBa£ØOH£©2£¬ĻūŗÄy mLHClČÜŅŗ£¬ĒāŃõ»Æ±µ×ÜĮæ¼õČ„±»ŃĪĖįµĪ¶ØĻūŗĵÄĪļÖŹµÄĮ棬ŅĄ¾ŻĒāŃõ»Æ±µČÜŅŗĪüŹÕ¶žŃõ»ÆĢ¼Éś³ÉĢ¼Ėį±µ³ĮµķŗĶĖ®µÄ»Æѧ·“Ó¦µÄ¶ØĮæ¹ŲĻµ¼ĘĖć£»
£Ø4£©¢ŁŅĄ¾ŻČČ»Æѧ·½³ĢŹ½ŗĶøĒĖ¹¶ØĀɼĘĖćµĆµ½·“Ó¦µÄģŹ±ä£»
¢ŚCO2 £Øg£©+H2£Øg£©?CO£Øg£©+H2O£Øg£©£¬·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬øıäŃ¹ĒæĘ½ŗā²»±ä£¬¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹ²»±ä£¬·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ĪĀ¶ČÉżøßĘ½ŗāÄęĻņ½ųŠŠ£¬¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹ¼õŠ”£¬¾Ż“Ė»³ö±ä»ÆµÄĶ¼Ļó£®
½ā“š ½ā£ŗ£Ø1£©A£®¹ż¶ČÅÅ·ÅCO2ŠĪ³ÉĪĀŹŅŠ§Ó¦£¬Ņ²Éś³ÉµÄĢ¼Ėį²»ĪČ¶Ø£¬¶žŃõ»ÆĢ¼ŗĶĖ®²»ÄÜŠĪ³ÉĖįÓź£¬SO2ŗĶNO2ĘųĢå¹ż¶ČÅÅ·ÅŠĪ³ÉĖįÓź£¬¹ŹA“ķĪó£»
B£®ĀĢÉ«Ö²ĪļŌŚ¹āŗĻ×÷ÓĆÖŠÖĘŌģŃõ£¬³¬¹żĮĖ×ŌÉķŗōĪü×÷ÓƶŌŃõµÄŠčŅŖ£¬ĘäÓąµÄŃõĘų¶¼ŅŌĘųĢåŠĪŹ½Åŵ½ĮĖ“óĘųÖŠ£»ĀĢÉ«Ö²Īļ»¹Ķعż¹āŗĻ×÷ÓĆ£¬²»¶ĻĻūŗÄ“óĘųÖŠµÄ¶žŃõ»ÆĢ¼£¬ÕāŃł¾ĶĪ¬³ÖĮĖÉśĪļȦ֊¶žŃõ»ÆĢ¼ŗĶŃõĘųµÄĻą¶ŌĘ½ŗā£¬¼ņ³ĘĢ¼-ŃõĘ½ŗā£®ÉśĪļĢåĄūÓĆŃõĘų£¬½«ĢåÄŚµÄÓŠ»śĪļ·Ö½ā³É¶žŃõ»ÆĢ¼ŗĶĖ®£¬Ķ¬Ź±ŹĶ·Å³öÄÜĮæµÄ¹ż³Ģ½Š×öŗōĪü×÷ÓĆ£¬ŹĒŅ»ĒŠÉśĪļµÄ¹²Ķ¬ĢŲÕ÷£»Ö²ĪļĢåÄŚµÄĖ®·ÖŅŌĘųĢåדĢ¬“ÓĢåÄŚÉ¢·¢µ½Ö²ĪļĢåĶāµÄ¹ż³Ģ½Š×öÕōĢŚ×÷ÓĆ£¬ÕōĢŚ×÷ÓĆÄܹ»½µµĶÖ²ĪļĢåµÄĪĀ¶Č£¬“Ł½ųÖ²Īļøł¶ŌĖ®ŗĶĪŽ»śŃĪµÄĪüŹÕŗĶŌĖŹä£¬¶ŌÖ²ĪļµÄÉś»ī¾ßÓŠÖŲŅŖµÄŅāŅ壬Ņņ“ĖÓėÉśĪļȦ֊Ģ¼-ŃõĘ½ŗāÓŠ¹ŲµÄÉśĄķ×÷ÓĆŹĒ¹āŗĻ×÷ÓĆ£¬¹ŹBÕżČ·£»
C£®ŹÆÓĶµÄÖ÷ŅŖ³É·ÖĪŖĶéĢž£¬ĆŗŹĒÓÉÓŠ»śĪļŗĶĪŽ»śĪļ×é³ÉµÄø“ŌӵĻģŗĻĪļ£¬Ö÷ŅŖ³É·ÖĪŖÓŠ»śĪļ£¬¹ŹCÕżČ·£»
D£®ÉśĪļȦ֊µÄĢ¼Ń»·Éę¼°ŗ¬Ģ¼µÄ»ÆŗĻĪļÖ®¼äæÉŅŌĻą»„×Ŗ»Æ£¬Ģ¼ĖįµÄŠĪ³É”¢Ģ¼ĖįµÄ·Ö½ā”¢Ģ¼ĖįøĘŗĶĢ¼ĖįĒāøĘÖ®¼äµÄ×Ŗ»ÆµČ¶¼²»Éę¼°»ÆŗĻ¼ŪµÄ±ä»Æ£¬¹ŹD“ķĪó£®
¹Ź“š°øĪŖ£ŗBC£»
£Ø2£©¶ÆĪļĶعżŗōĪü×÷ÓĆ½«ĘĻĢŃĢĒ×Ŗ»ÆĪŖCO2µÄ·“Ó¦ĪŖĘĻĢŃĢĒŗĶŃõĘųŌŚĆø×÷ÓĆĻĀ·“Ӧɜ³É¶žŃõ»ÆĢ¼ŗĶĖ®£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗC6H12O6+6O2$\stackrel{Ćø}{”ś}$6CO2+6H2O£¬
¹Ź“š°øĪŖ£ŗC6H12O6+6O2$\stackrel{Ćø}{”ś}$6CO2+6H2O£»
£Ø3£©¢Ł×°ÖĆAµÄ×÷ÓĆŹĒ³żČ„SO2”¢NO2£¬·ĄÖ¹¶ŌBa£ØOH£©2ĪüŹÕ¶žŃõ»ÆĢ¼²śÉśøÉČÅ£¬
¹Ź“š°øĪŖ£ŗ³żČ„SO2”¢NO2£¬·ĄÖ¹¶ŌBa£ØOH£©2ĪüŹÕ¶žŃõ»ÆĢ¼²śÉśøÉČÅ£»
¢ŚŃé½įŹųŗ󣬻¹ŠčŅŖĻņ×°ÖĆÖŠĶØČėN2£¬ĘäÄæµÄŹĒ£ŗ½«×°ÖĆAÖŠµÄĘųĢåøĻČė×°ÖĆB£¬Č·±£CO2±»ĶźČ«ĪüŹÕ£¬
¹Ź“š°øĪŖ£ŗ½«×°ÖĆAÖŠµÄĘųĢåøĻČė×°ÖĆB£¬Č·±£CO2±»ĶźČ«ĪüŹÕ£»
¢ŪĒāŃõ»Æ±µČÜŅŗÖŠŗ¬ĒāŃõ»Æ±µĪļÖŹµÄĮæĪŖbmol£¬ÓĆĄ“ĪüŹÕ¶žŃõ»ÆĢ¼µÄĒāŃõ»Æ±µĪļÖŹµÄĮæ=bmol-$\frac{1}{2}$xy”Į10-3mol£¬CO2+Ba£ØOH£©2=BaCO3”ż+H2O
¶žŃõ»ÆĢ¼ĪļÖŹµÄĮæ=bmol-$\frac{1}{2}$xy”Į10-3mol£¬ŃłĘ·£Øa g£©ÖŠĢ¼ŌŖĖŲµÄÖŹĮæ·ÖŹż=$\frac{£Øb-\frac{1}{2}xy”Į1{0}^{-3}£©mol”Į12g/mol}{ag}$”Į100%=$\frac{£Øb-\frac{1}{2}xy”Į1{0}^{-3}£©”Į12}{a}$”Į100%£¬
¹Ź“š°øĪŖ£ŗ$\frac{£Øb-\frac{1}{2}xy”Į1{0}^{-3}£©”Į12}{a}$”Į100%£»
£Ø4£©¢ŁŅĄ¾ŻČČ»Æѧ·½³ĢŹ½£¬
·“Ó¦¢ń£ŗCO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£©”÷H1=-49.1kJ/mol
·“Ó¦¢ņ£ŗCO2 £Øg£©+H2£Øg£©?CO£Øg£©+H2O£Øg£©”÷H2
·“Ó¦¢ó£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H3=-90.0kJ/mol
½įŗĻøĒĖ¹¶ØĀɼĘĖć·“Ó¦¢ņ=·“Ó¦¢ń-·“Ó¦¢ó£¬µĆµ½CO2 £Øg£©+H2£Øg£©?CO£Øg£©+H2O£Øg£©”÷H2 =”÷H1-”÷H3=+40.9KJ/mol
µĆµ½·“Ó¦¢ņµÄģŹ±äĪŖ+40.9KJ/mol£¬
¹Ź“š°øĪŖ£ŗ+40.9KJ/mol£»
¢ŚCO2 £Øg£©+H2£Øg£©?CO£Øg£©+H2O£Øg£©”÷H2=+40.9KJ/mol£¬·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬øıäŃ¹ĒæĘ½ŗā²»±ä£¬¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹ²»±ä£¬·“Ó¦ŹĒĪüČČ·“Ó¦£¬ĪĀ¶ČÉżøßĘ½ŗāÕżĻņ½ųŠŠ£¬¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹŌö“ó£¬T1£¾T2£¬Ōņ¶žŃõ»ÆĢ¼×Ŗ»ÆĀŹT1“󣬾Ż“Ė»³ö±ä»ÆµÄĶ¼ĻóĪŖ£ŗ £¬
£¬
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾Ģāæ¼²éĮĖĢ¼¼°Ęä»ÆŗĻĪļ×Ŗ»Æ¹ż³ĢÖŠµÄ·ÖĪöÓ¦ÓĆ£¬ĘųĢåĪüŹÕŗĶĘųĢå³żŌӵďµŃéŌĄķ£¬ČČ»Æѧ·½³ĢŹ½ŹéŠ“£¬Ó°Ļģ»ÆŃ§Ę½ŗāŅņĖŲµÄĄķ½āÓ¦ÓĆŗĶĶ¼Ļó±ä»»£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻąĶ¬ÅØ¶ČµÄĮ½ČÜŅŗÖŠc£ØOH-£© ĻąĶ¬ | |
| B£® | pH=13µÄĮ½ČÜŅŗĻ”ŹĶ100±¶£¬pH¶¼ĪŖ11 | |
| C£® | 100 mL 0.1 mol/LµÄĮ½ČÜŅŗÄÜÖŠŗĶµČĪļÖŹµÄĮæµÄŃĪĖį | |
| D£® | Į½ČÜŅŗÖŠ·Ö±š¼ÓČėÉŁĮæ¶ŌÓ¦µÄĮņĖįŃĪ¹ĢĢ壬c£ØOH-£© ¾łĆ÷ĻŌ¼õŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
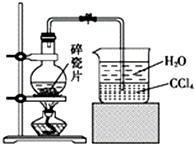 1-äåŅģĪģĶé[£ØCH3£©2CHCH2CH2Br]ŹĒÓŠ»śŗĻ³ÉµÄÖŲŅŖÖŠ¼äĢ壬æÉÓĆÓŚÉś²śČ¾ĮĻ”¢“߻ƼĮµČ£¬Ęä·ŠµćĪŖ121”ę£¬Ņ×ČÜÓŚCCl4£¬æÉÓÉŅģĪģ“¼ÓėĒāäåĖįŌŚĮņĖį“ß»Æ×÷ÓĆĻĀ·“Ó¦¶ųµĆ£ŗ£ØCH3£©2CHCH2CH2OH+HBr$\stackrel{”÷}{”ś}$£ØCH3£©2CHCH2CH2Br+H2O£®ŅŃÖŖŅģĪģ“¼µÄ·ŠµćĪŖ132.5”ę£¬Ī¢ČÜÓŚĖ®£¬Ņ×ČÜÓŚCCl4£®ŹµŃéŹŅÖʱø1-äåŅģĪģĶéµÄ×°ÖĆČēĶ¼ĖłŹ¾£®
1-äåŅģĪģĶé[£ØCH3£©2CHCH2CH2Br]ŹĒÓŠ»śŗĻ³ÉµÄÖŲŅŖÖŠ¼äĢ壬æÉÓĆÓŚÉś²śČ¾ĮĻ”¢“߻ƼĮµČ£¬Ęä·ŠµćĪŖ121”ę£¬Ņ×ČÜÓŚCCl4£¬æÉÓÉŅģĪģ“¼ÓėĒāäåĖįŌŚĮņĖį“ß»Æ×÷ÓĆĻĀ·“Ó¦¶ųµĆ£ŗ£ØCH3£©2CHCH2CH2OH+HBr$\stackrel{”÷}{”ś}$£ØCH3£©2CHCH2CH2Br+H2O£®ŅŃÖŖŅģĪģ“¼µÄ·ŠµćĪŖ132.5”ę£¬Ī¢ČÜÓŚĖ®£¬Ņ×ČÜÓŚCCl4£®ŹµŃéŹŅÖʱø1-äåŅģĪģĶéµÄ×°ÖĆČēĶ¼ĖłŹ¾£®| ·“Ó¦Īļ | NaBr | 98.3% ÅØH2SO4 | ŅģĪģ“¼ | Ė® |
| ÓĆĮæ | 0.30mol | 35mL£Ø¹żĮ棩 | 0.25mol | 30mL |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ZnŗĶÅØH2SO4 | B£® | CŗĶÅØHNO3 | ||
| C£® | CuŗĶÅØHNO3 | D£® | Na2O2ŗĶNH4ClÅØČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņNaClOČÜŅŗÖŠĶØČė¹żĮæSO2£ŗClO-+SO2+H2OØTHClO+HSO3- | |
| B£® | Na2SĶ¶ČėĖ®ÖŠ£ŗS2-+2H2O?H2S+2OH- | |
| C£® | Ļņŗ¬1molAlCl3ČÜŅŗÖŠĶ¶Čė4molNa£ŗAl3++4Na+2H2OØTAlO2-+4Na++2H2”ü | |
| D£® | ĻņĆ÷·ÆČÜŅŗÖŠµĪ¼ÓBa£ØOH£©2ČÜŅŗ£¬Ē”ŗĆŹ¹SO42-³ĮµķĶźČ«£ŗ2Al3++3SO42-+3Ba2++6OH-ØTAl£ØOH£©3”ż+3BaSO4”ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ZĪŖ0.3 | B£® | Y2ĪŖ0.4 | C£® | X2ĪŖ0.2 | D£® | ZĪŖ0.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ijČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc£ØH+£©=1”Į10-amol•L-1£¬Čōa£¾7Ź±£¬ŌņøĆČÜŅŗµÄpHŅ»¶ØĪŖ14-a | |
| B£® | ½«0.2mol•L-1µÄijŅ»ŌŖĖįHAČÜŅŗŗĶ0.1mol•L-1µÄNaOHČÜŅŗµČĢå»ż»ģŗĻŗóČÜŅŗµÄpH“óÓŚ7£¬Ōņ·“Ó¦ŗóµÄ»ģŗĻŅŗ£ŗc£ØHA£©£¾c£ØA-£© | |
| C£® | Na2CO3ČÜŅŗ£ŗc£ØNa+£©=c£ØCO32-£©+c£ØHCO3-£©+c£ØH2CO3£© | |
| D£® | ³£ĪĀĻĀNaHSO3ČÜŅŗµÄpH£¼7£¬ČÜŅŗÖŠc£ØSO32-£©£¼c£ØH2SO3£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŅĪŖAlC13 | |
| B£® | ÄÜ“óĮæ¹²“ęÓŚČÜŅŗ±ūÖŠµÄĄė×Ó£ŗFe3+”¢SO42-”¢NO3- | |
| C£® | ¼×ČÜŅŗÖŠĮ£×ӵĵČĮæ¹ŲĻµ£ŗc£ØNa+£©=c£ØHCO3-£©+c£ØCO32-£©+c£ØH2CO3£© | |
| D£® | ¼×ČÜŅŗÖŠµĪ¼ÓÉŁĮ涔ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗHCO3-+Ba2++OH-ØTBaCO3”ż+H2O |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com