
| A. | 2-甲基-2-氯丙烷 | B. | 3-氯戊烷 | C. | 2-溴丁烷 | D. | 1-氯丁烷 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度/(mol•L-1) | NaOH物质的量 浓度/(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| B. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu最外层电子数相同 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U化学性质完全相同 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水,浓H2SO4 | B. | 酸性KMnO4溶液,浓H2SO4 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓H2SO4,酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
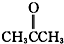 酮类 ③CH3CH2Br卤代烃
酮类 ③CH3CH2Br卤代烃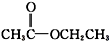 酯类 ⑤
酯类 ⑤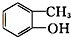 酚类 ⑥
酚类 ⑥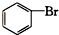 卤代烃
卤代烃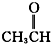 醛类 ⑧
醛类 ⑧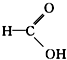 羧酸类 ⑨
羧酸类 ⑨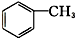 芳香烃.
芳香烃.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
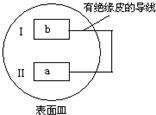 把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )| A. | a是原电池的负极 | B. | b的活泼性大于a | ||
| C. | 无电流产生 | D. | b 电极上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
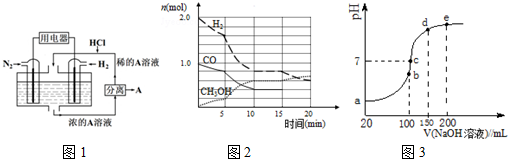
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com