
有NO和CO2的混合气体14 mL,通过足量的Na2O2后,体积变为7 mL,再通过水洗后体积变化为2 mL。试求混合气体中NO和CO2的体积各是多少毫升?
分析:此题结果有两种可能,一是剩余2 mL O2,二是剩余2 mL NO。
解:(1)若剩余2 mL O2
则通过Na2O2后的7mL气体为NO2与O2混合气。
设其中NO2为x,O2为7-x
4 NO2 + O2 + 2 H2O = 4 HNO3
4mL 1mL
x 7-x-2
x = 4mL
根据 2 NO + O2 = 2 NO2
故原混合气体中:NO为4 mL ,CO2为10 mL
(2)若剩余2 mL NO
由于 2 CO2 + 2 Na2O2 + 2 Na2CO3 + O2
2 NO + O2 = 2 NO2
所以 CO2 + NO + Na2O2 = Na2CO3 + NO2
原混合气体14mL通过Na2O2后,体积减少一半,可推知原混合气体中两种气体的体积比为![]() ≥1,即7mL气体只可能是NO2和O2的混合气体或纯净NO2,不存在NO。水洗后2 mL NO应来源于3 NO2 + H2O = 2 HNO3 + NO。
≥1,即7mL气体只可能是NO2和O2的混合气体或纯净NO2,不存在NO。水洗后2 mL NO应来源于3 NO2 + H2O = 2 HNO3 + NO。
产生2 mL NO消耗6 mL NO2;余下1 mL 应是NO2与O2的混合气体,并按V(NO![]() )V(O
)V(O![]() ) = 41相混,即NO2为0.8 mL,O2为0.2 mL。
) = 41相混,即NO2为0.8 mL,O2为0.2 mL。
7mL 混合气中:V(NO![]() )= 6 mL+0.8 mL = 6.8 mL V(O
)= 6 mL+0.8 mL = 6.8 mL V(O![]() ) = 0.2 mL
) = 0.2 mL
故原混合气中:V(NO) = 6.8 mL V(CO![]() ) = 14 mLl -6.8 mL = 7.2 mL
) = 14 mLl -6.8 mL = 7.2 mL


科目:高中化学 来源: 题型:
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率
,则N2的转化率![]() ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为![]() ,则
,则![]()
![]() (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O24NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市大兴区高三上学期期末考试化学试卷(解析版) 题型:填空题
氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
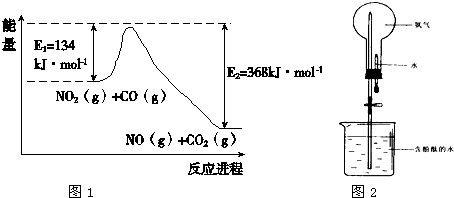
(1)根据右下能量变化示意图:

写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3
(g) ΔH<0,
2NH3
(g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1 K2(填“>”、“=”或“<”)
|
T /K |
298 |
398 |
|
平衡常数K |
K1 |
K2 |
(3)下列各项能说明该反应达到平衡状态的是 (填字母序号)
a. v(H2)正=3 v(N2)逆
b. 容器内压强保持不变
c. 容器中混合气体的密度保持不变
d.: N2 、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用下图实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红。

请回答:
①用化学用语说明所得氨水能使酚酞变红的原因 。
②250C时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为 (填字母序号)
a.c(Cl-)﹥c(NH4+) b.c(Cl-)﹦c(NH4+)
c. c(Cl-)﹤c(NH4+) d.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com