
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
分析 氧化还原反应的实质为电子转移、特征为化合价升降,所以氧化还原反应中一定存在元素化合价变化,据此对各选项进行判断.
解答 解:①3Cl2+6KOH═5KCl+KClO3+3H2O 反应中Cl元素的化合价发生变化,属于氧化还原反应,故正确;
②3NO2+H2O═2HNO3+NO反应中N元素的化合价发生变化,属于氧化还原反应,故正确;
③SnCl4+2H2O═SnO2+4HCl 反应中不存在化合价变化,不属于氧化还原反应,故错误;
④NaOH+HCl═H2O+NaCl反应中不存在化合价变化,不属于氧化还原反应,故错误.
故选A.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,试题有利于提高学生的灵活应用能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 1 mol | ||
| C. | >1 mol | D. | 0.6 mol<n(CO2)<1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古人利用明矾溶液的酸性来清洗青铜器上的铜锈 | |
| B. | 人体摄入适量的油脂有利于促进维生素的吸收 | |
| C. | 《肘后备急方》中记载“青蒿一握,以水二升渍,绞取汁”,所述过程不涉及化学变化 | |
| D. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷和乙酸乙酯 | B. | 乙醇和乙酸 | ||
| C. | 乙醇和乙酸乙酯 | D. | 苯乙烯和氯甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,平衡正向移动,达到新平衡时K值增大 | |
| B. | 升高温度,K值增大 | |
| C. | K越大,说明该反应的进行程度越大 | |
| D. | 该反应的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑧ | B. | ①④⑥⑧ | C. | ①④⑤⑥⑦ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
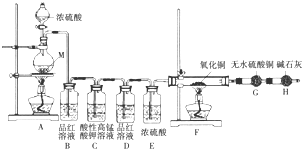
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
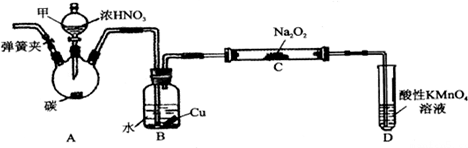
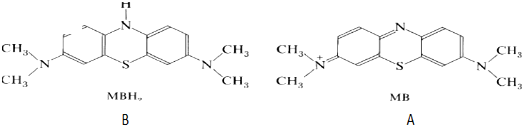
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com