
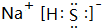 .
.分析 A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,则A为H元素;B元素的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;A、D同主族,D原子序数大于碳,故D为Na;E、F原子序数大于Na,处于第三周期,E元素的最外层电子数等于其电子层数,则E为Al;F元素的最外层电子数是次外层电子数的0.75倍,则最外层电子数为8×0.75=6,故F为S元素;C、F同主族,则C为O元素,据此解答.
解答 解:A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,则A为H元素;B元素的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;A、D同主族,D原子序数大于碳,故D为Na;E、F原子序数大于Na,处于第三周期,E元素的最外层电子数等于其电子层数,则E为Al;F元素的最外层电子数是次外层电子数的0.75倍,则最外层电子数为8×0.75=6,故F为S元素;C、F同主族,则C为O元素.
(1)A、D、F形成化合物为NaHS,电子式为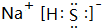 ,故答案为:
,故答案为: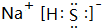 ;
;
(2)工业上在高温的条件下,可以用H2O和CO反应制取单质H2,发生反应为:H2O+CO H2+CO2,
H2+CO2,
在2L密闭容器中分别充入1mol H2O和1mol CO,一定条件下,2min达平衡时生成0.4mol H2,则参加反应的CO为0.4mol,则用CO表示的反应速率为$\frac{\frac{0.4mol}{2L}}{2min}$=0.1mol/(L.min);
A.增加CO2的浓度,瞬间正反应速率不变、逆反应速率增大,而后平衡向逆反应方向移动,逆反应速率减小、正反应速率增大,故A错误;
B.容器体积不变,混合气体总质量不变,则若混合气体的密度始终不变,故B错误;
C.H2燃烧生成水,没有污染,是一种高效优质新能源,故C正确;
D.反应中化合价降低的元素只有H原子,由+1价降低为p价,生成1mol H2,转移2mol 电子,故D正确,
故答案为:0.1mol/(L.min);CD;
(3)氢气、氧气、NaOH溶液构成燃料电池,氢气在负极失电子,碱性条件下生成水,其负极的电极反应式为:2H2-4e-+4OH-═4H2O,氧气在正极获得电子生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O═4OH-,
故答案为:2H2-4e-+4OH-═4H2O;O2+4e-+2H2O═4OH-.
点评 本题考查结构性质位置关系、反应速率计算、化学平衡问题、原电池等,推断元素是解题的关键,难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 21:12:4 | B. | 5:5:4 | C. | 5:5:1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略).
(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略). .
.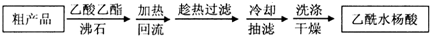
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
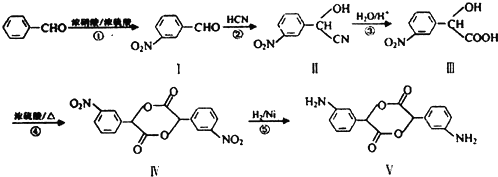
 和
和 .
.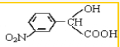 →
→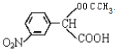 +H2O(不要求写出反应条件);用丙酮(
+H2O(不要求写出反应条件);用丙酮( 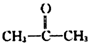 )代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.
)代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作(或设计) | 实验现象 | 结论 | |
| A | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | 酸性:HB>HA |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡 | 镁作原电池的负极 |
| C | 相同温度下,等质量的大理石与等体积等浓度的盐酸反应 | 粉状大理石产生气泡更快 | 反应速率: 粉状大理石>块状大理石 |
| D | 向盛有10滴0.1mol•L-1 AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 NaI溶液 | 先有白色沉淀,后转成黄色沉淀 | Ksp(AgCl )>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学键的断裂和行成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2 反应生成1mol H2O释放能量一定为245kJ | |
| D. | 2mol H2(g)跟1mol O2 (g)反应生成2mol H2O(g)释放能量490kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com