
分析 (1)发生反应:CuSO4+Fe=Cu+FeSO4;
(2)利用固体质量差量法计算参加反应Fe的质量;
(3)由原子守恒可知n(FeSO4)=n(Fe),根据c=$\frac{n}{V}$计算.
解答 解:(1)反应离子方程式为:Cu2++Fe=Cu+Fe2+,
答:反应离子方程式为Cu2++Fe=Cu+Fe2+.
(2)CuSO4+Fe=Cu+FeSO4 △m
56g 64g 8g
m(Fe) (46.6-45.0)g
56g:8g=m(Fe):(46.6-45.0)g
解得:m(Fe)=11.2g
答:参加反应铁的质量为11.2g;
(3)由原子守恒可知n(FeSO4)=n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,故所得溶液中FeSO4的物质的量浓度为$\frac{0.2mol}{0.1L}$=2mol/L,
答:所得溶液中FeSO4的物质的量浓度为2mol/L.
点评 本题考查化学方程式计算、离子方程式书写等,比较基础,注意根据质量守恒定律理解质量差量法.


科目:高中化学 来源: 题型:选择题
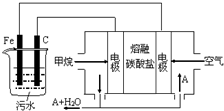 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
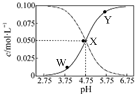 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )| A. | Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| C. | 该温度下醋酸的电离平衡常数为10-1 mol•L-1 | |
| D. | 向X点所表示的溶液中加入等体积的0.05 mol•L-1 NaOH溶液:c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用50mL的量筒量取45.50mL的水 | |
| B. | 将40gNaOH溶解于1L水中配得1mol/L的溶液 | |
| C. | CCl4萃取碘水的实验中,分液时,水层液体从下口流出 | |
| D. | 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸保存在带有玻璃塞的棕色试剂瓶中 | |
| B. | 已经完成定容的500mL 1.0mol•L-1的NaOH溶液,某同学不慎将容量瓶中溶液洒出部分,继续加水至溶液凹液面与刻线相切 | |
| C. | 用托盘天平称量出12.50g的NaCl固体 | |
| D. | 物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.1g | B. | 3.6g | C. | 5.7g | D. | 37.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CaCO3(s)═CaO(s)+CO2(g)在常温下不能自发进行,则该反应的△H<0 | |
| B. | 0.lmol•L一1CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值减小 | |
| C. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| D. | 锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com