
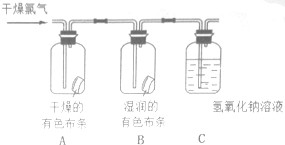
 为了验证氯气的有关行政,某同学设计了如下的实验.
为了验证氯气的有关行政,某同学设计了如下的实验.分析 (1)氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,次氯酸具有漂白性,氯气没有漂白性;
(2)根据氯气和水反应的产物是盐酸和次氯酸,证明二者谁有漂白性,在实验设计中,需要设计一个对照实验,即在一个红色布条上滴加盐酸,布条无变化,才能证明起漂白作用的物质只能是次氯酸;
(3)C瓶中的氢氧化钠溶液是吸收多余的氯气防止污染空气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(4)根据氯气和氢氧化钠反应的方程式中的定量关系计算,氯气物质的量n=$\frac{V}{22.4}$mol,可以求得所需氢氧化钠的物质的量,溶液体积V=$\frac{n}{c}$计算得到.
解答 解:(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,从集气瓶B中湿润的红色布条的现象可得出的结论是HClO能漂白,因为氯气和水反应Cl2+H2O=HCl+HClO,生成的次氯酸具有漂白性,
故答案为:干燥的Cl2没有漂白性;HClO具有漂白性;Cl2+H2O=HCl+HClO;
(2)Cl2+H2O=HCl+HClO,所以需要设计一个实验在一个红色布条上滴加盐酸,布条无变化,排除氯化氢的漂白性,就证明起漂白作用的物质是次氯酸,
故答案为:证明盐酸是否有漂白性;
(3)氯气有毒污染空气,不能直接排放到空气中,C瓶中的氢氧化钠溶液用来吸收多余的氯气,防止污染空气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:吸收多余的氯气,防止污染空气;Cl2+2OH-=Cl-+ClO-+H2O;
(4)4分钟时n(Cl2)=$\frac{1.12L×4}{22..4L/mol}$=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,需要n(NaOH)=0.4mol,所以V(NaOH)=$\frac{0.4mol}{2mol/L}$=0.2L=200mL,
故答案为:200.
点评 本题考查氯气的化学性质,明确氯气与水、与碱的反应及次氯酸的性质,并学会利用实验中的对比来分析解答问题是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将标准状况下1.12 L NH3溶于500 mL水中 | |
| B. | 将标准状况下1.12 L NH3溶于水配成500 mL溶液 | |
| C. | 取1 mol•L-1的氨水50 mL,加入500 mL水中 | |
| D. | 取1 mol•L-1的氨水100 mL,配成1 000 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
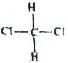 和
和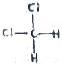
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是254 | B. | 质量数是102 | C. | 中子数是152 | D. | 电子数是254 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com