
| A. | 容器内压强不再发生变化 | |
| B. | v正(CO)=v正(H2O) | |
| C. | 生成n mol CO的同时,消耗n mol H2O | |
| D. | 1 mol H-H键断裂的同时,形成2 mol H-O键 |
分析 可逆反应C (s)+H2O(g)?CO(g)+H2(g)是一个反应前后气体体积增大的可逆反应,当该反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.碳为固态,该反应前后气体体积不相等,则反应过程中容器内压强为变量,当压强不变时,表明正逆反应速率相等,达到了平衡状态,故A正确;
B.v正(CO)=v正(H2O),没有指出正逆反应速率,无法判断是否达到平衡状态,故B错误;
C.生成n mol CO的同时,消耗n mol H2O,表示的都是正反应速率,无法判断是否达到平衡状态,故C错误;
D.1molH-H键断裂的同时,形成2 mol H-O键,表示的都是逆反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,注意该反应中反应前后气体质量改变,为易错点.


科目:高中化学 来源: 题型:推断题
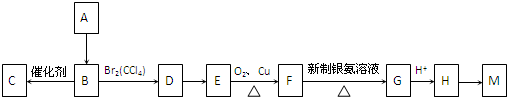
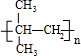 ,M的结构简式为
,M的结构简式为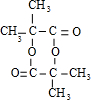 .
.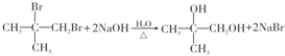 ;
;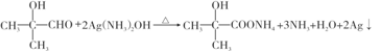 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的一氯代物只有一种 | ||
| C. | 苯的二氯代物只有三种 | D. | 苯分子中六个碳碳键键长完全相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 240 | 250 | 260 | 270 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡气体总浓度/ mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
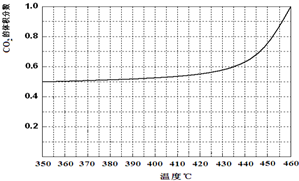
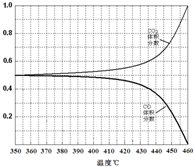 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
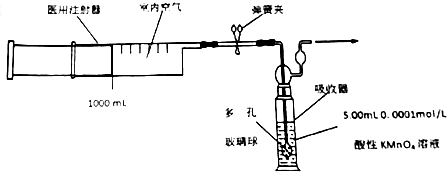
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等 | |
| B. | 100 mL 1 mol•L-1的盐酸和50 mL 2 mol•L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等 | |
| C. | 100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等. | |
| D. | 100 mL 0.1mol•L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com