
下列说法正确的是
A.凡能发生银镜反应的有机物一定是醛
B.在氧气中燃烧时只生成CO2和H2O的物质一定是烃
C.苯酚有弱酸性,俗称石炭酸,因此它是一种羧酸
D.在酯化反应中,羧酸脱去羧基中的羟基,醇脱去羟基中的氢而生成水和酯
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
甲基环丙烷的二氯代物的数目有(不考虑立体异构)( )
A.4 种 B.5 种 C.6 种 D.7种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北武邑中学高一下5.15周考化学试卷(解析版) 题型:简答题
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,己知常温常压下下列反应的能量关系如图:
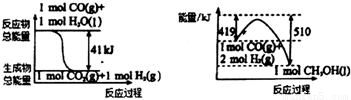
则CO2与H2反应生成液态CH3OH 的热化学方程式为_______________________。
(2)CH4 和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g) CO(g)+3H2(g); △H1>0
CO(g)+3H2(g); △H1>0
II.CO(g)+2H2(g) CH3OH(g); △H2<0
CH3OH(g); △H2<0
将1.0molCH4 和3.0molH2O (g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。
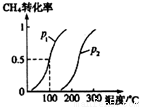
① 图中的P1___P2(填“<”、“>”或“=”) ,判断的理由是________________。
② 若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是______(填序号)。
A.生成CH3OH 的速率与消耗CO 的速率相等 B.混合气体的密度不变
C.混合气体的总物质的量不变 D.CH3OH、CO、H2的浓度都不再发生变化
③在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol· L-1)变化如下表所示:
2min | 5min | 10min | |
CO | 0.07 | 0.06 | 0.05 |
H2 | 0.14 | 0.12 | 0.20 |
CH3OH | 0.03 | 0.04 | 0.05 |
若5min时只改变了某一条件,则所改变的条件是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北武邑中学高一下5.15周考化学试卷(解析版) 题型:选择题
有M、X、Y、Z、W五种原子序数依次增大的短周期元素,其中M、Z同主族;x+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法正确的是( )
A.X、M两种元素形成的化合物中只能存在离子键
B.元素Z的某种氧化物具有漂白性,是因为这种氧化物具有强氧化性
C.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
D.元素W和M的某些单质可作为水处理中的消毒剂
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三5月考前模拟理综化学试卷(解析版) 题型:简答题
Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g) + 2CO(g) 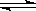 CH3OCH3(g) + H2O(g) ∆H=-198kJ/mol。
CH3OCH3(g) + H2O(g) ∆H=-198kJ/mol。
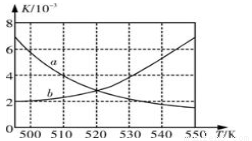
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线是 (填曲线标记字母),其判断理由是 。
(2)在一定温度下,向2.0L固定的密闭容器中充入2molH2 和1molCO,经过一段时间后,反应4H2(g) + 2CO(g) 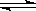 CH3OCH3(g) + H2O(g) 达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g) + H2O(g) 达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO) /mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3) /mol | 0 | 0.15 | — | — | 0.4 |
n(H2O) /mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0—20min的平均反应速率V(co)= mol/(L·min);
②达平衡时,H2 的转化率为: ;
③在上述温度下,向平衡后的2L容器中再充入0.4molH2 和0.4molCH3OCH3 (g),则化学平衡 (向“正向”、“逆向”或“不”)移动。
(3)用Li2CO3 和Na2CO3 的熔融盐混合物作为电解质,CO为负极燃气,空气与CO2 的混合气体作为正极助燃气,制得在650℃工作的燃料电池,则负极反应式为:
,当燃料电池的电路中有0.2NA个电子发生转移,则标况下生成 _______升CO2 。
Ⅱ:已知在25℃时,Ksp[Mg(OH)2 ]=1.8X10-11,Ksp[Cu(OH)2 ]=2.2X10-20,在25℃下,向浓度均为0.1mol/L的MgCl2 和CuCl2 混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)生成该沉淀的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三5月考前模拟理综化学试卷(解析版) 题型:选择题
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.X2-的还原性一定大于Y-
B.由mXa+与nYb-得,m+a=n﹣b
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期中化学试卷(解析版) 题型:选择题
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X只能与元素Y形成一种化合物
C.元素W、R的最高价氧化物的水化物都是强酸
D.元素Y、R分别与元素X形成的化合物的热稳定性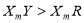
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一下期中化学试卷(解析版) 题型:选择题
元素性质呈周期性变化的根本原因是
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com