
【题目】下列说法中正确的是
A. 用pH试纸测定NaClO溶液的pH
B. 用碱石灰干燥氨气
C. 过滤时用玻璃棒不断搅拌浊液,以加快过滤速度
D. 用向上排气法收集铜与稀硝酸反应生成的NO气体
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关。下列叙述不正确的是( )
A. 合成纤维和光导纤维都是新型无机非金属材料
B. 煤的气化和液化均属于化学变化
C. 医疗中常用酒精来消毒,是因为酒精能够使细菌蛋白质发生变性
D. NO2和SO2都是可形成酸雨的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、对N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);
2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);

(1)比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______.
(2)若容器容积为1L,n=5mol,T2条件下反应达到平衡时H2的转化率为60%,则且H2与N2物质的量之比为1:1,则在起始时体系中加入N2的物质的量为______mol,反应的平衡常数K=______.
Ⅱ、煤制天然气的工艺流程如图所示:

(3)反应Ⅰ:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+135kJ/mol,
CO(g)+H2(g) ΔH=+135kJ/mol,
①通入的氧气会与部分碳发生燃烧反应。请利用能量转化及配合移动原理说明通入氧气的作用:_______。
②若反应Ⅰ在体积不变的密闭容器中进行,下列能说明反应Ⅰ达到平衡状态的是________。
a.压强不变 b.气体密度不变 c.气体平均摩尔质量不变 d.氢气浓度不变
(4)反应Ⅱ:C0(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
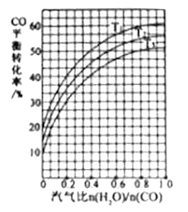
①判断T1、T2和T3的大小关系:________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1:3,则反应Ⅱ应选择的温度是_________(填“T1”或“T2”或“T3”)。
(5)实验室模拟甲烷化反应:一定条件下,向体积为2L的恒容密闭容器中充入1.2molCH4(g)和4.8molCO2(g),发生反应CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。
2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素的单质和化合物性质判断元素非金属性强弱的依据是
①元素最高价氧化物的水化物的碱性强弱 ②元素最高价氧化物的水化物的酸性强弱
③元素单质跟酸反应置换出氢的难易 ④元素单质跟氢气生成气态氢化物的难易
A.①②③④ B.③④ C.①②④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】品味生活,感知化学
(1)“美食名粽,品位海南”,2017年5月20日海南名粽展销会拉开帷幕。海南粽子的主要食材有:糯米、猪肉、咸蛋黄等。
①以上食材中富含淀粉的是________________;
②从平衡膳食的角度看,吃海南粽子时,还应补充适量的_____________(填营养素名称);
③海南粽子经过真空包装,并添加一定的抗氧化剂后销往各地,抗氧化剂所起的作用是________________
(填“着色”或“防腐”或“调味”);
④粽叶一般选择新鲜的植物叶子,剥下的粽叶为实现无害化、资源化处理,写出一种合理的处理方法_________________________。
(2)下图是一辆大气环境监测汽车,请回答下列问题:

①汽车轮胎所用的主要材料是_________________。
②汽车外壳会喷上各种颜色的油漆,一方面能起到美化作用,另一方面油漆还能为钢铁材料起到________________作用;
③汽车的内饰材料若不合格,易产生一些挥发性有毒物质如________(填“甲醛”或“甲烷”或“乙醇”)而对车内空气造成污染;
④目前,大气环境监测公布的主要污染物有硫的氧化物、氮的氧化物和________(填字母)。
a.二氧化碳 b.氮气 c.可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或用途的叙述中,正确的是
A.常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车
B.用氯化钡溶液可区别SO42-和CO32-离子
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.二氧化硅是一种酸性氧化物,它不跟任何酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁加热至高温会分解,生成—种金属氧化物M和两种非金属氧化物。某化学研究小组利用下列装置加热至高温使FeSO4分解。

实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通入一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却。
(1)已知M中铁元素的质量分数为70%,M的化学式为_____________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置进行实验。
操作步骤 | 实验现象 | 用方程式解释原因 |
打开K,通入一段时间N2,关闭K。加热A中玻璃管一段时间 | 洗气瓶B中①__________ | ②______________ |
A中固体不再分解后,停止加热,打开K,缓慢通入N2至玻璃管冷却 | 硬质玻璃管最终可以看到③_______________ | ④______________ |
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→______→______。
②能证明生成了非金属氧化物N的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 制作印刷电路板:Fe3++Cu===Cu2++Fe2+
B. 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO![]() ===BaSO4↓+2H2O
===BaSO4↓+2H2O
C. Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO![]() +2OH-===2CaCO3↓+2H2O+CO
+2OH-===2CaCO3↓+2H2O+CO![]()
D. 新制饱和氯水中加入石灰石可提高溶液中HClO浓度:CaCO3+2Cl2+H2O===Ca2++2Cl-+CO2↑+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素镍(Ni)在溶液中+3价极不稳定,主要以Ni2+(绿色)、[Ni(NH3)6]2+(蓝色)、[Ni(CN)4]2-(橙黄色)、[Ni(CN)5]3-(深红色)等形式存在。Ni(OH)2为难溶于水的浅绿色固体。
(1)Ni2+与Ag+化学性质相似。在NiSO4溶液中逐滴加入氨水直至过量,可观察到的现象是_________________。溶液中某离子浓度≤1.0×10-5mol·L-1可认为沉淀完全。室温下Ni(OH)2饱和溶液的pH=9,则溶液中的Ni2+恰好沉淀完全时的pH__________9(填“>”或“=”或“<”)。
(2)镍作为一种催化剂被广泛用于有机合成反应中,其制备原料是镍铝合金。通常用_____浓液处理该合金可制得多孔结构的镍,制备过程发生反应的离子方程式为____________。
(3)[Ni(CN)4]2-和[Ni(CN)5]3-在溶液中可相互转化。室温下,某溶液中[Ni(CN)4]2-的转化率(α)与平衡时c(CN-)的关系如图所示。

①用离子方程式表示[Ni(CN)4]2-在溶液中的转化反应________________________。
②由图可知平衡转化率为50%时,c(CN-)=_________mol·L-1(用含a的代数式表示)。
③已知该反应的△H<0,升高温度,该反应的平衡常数__________(选填“增大”或“减小”或“不变”)。
(4)NiO(OH)为难溶于水的黑色固体,但可溶于浓盐酸并形成绿色溶液,其离子方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com