
(一) 尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g)  H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
第二步:H2NCOONH4(l)  H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
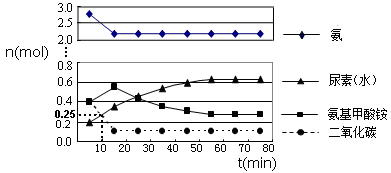
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_________(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
氨气溶于水得到氨水,在25℃下,将amol/L的氨水与bmol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g) CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
A.容器内的压强不变 B.消耗水蒸气的物质的量与生成CO的物质的量相等
C.混合气的密度不变 D.单位时间有n个H-O键断裂的同时有n个H-H键断裂
②x应满足的条件是 。
(四)CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2。华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
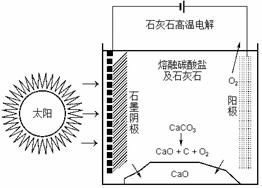
(1)上述生产过程的能量转化方式是 。
(2)上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
科目:高中化学 来源: 题型:
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e一= HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾
(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:
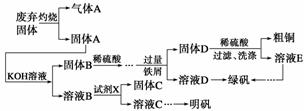
(1)试剂X是________(写化学式)。
(2)配平下列方程式
MnO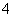 +____SO2+____H2O===____Mn2++____SO
+____SO2+____H2O===____Mn2++____SO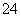 +____H+
+____H+
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0 g 样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用 1.000×10-1 mol·L-1的KMnO4标准溶液进行滴定(MnO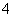 被还原为Mn2+)。
被还原为Mn2+)。
请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在______________中(填仪器名称)。
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为_____ ___。
___。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,反应aX(g) 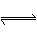 bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是
bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是
A.a>b+c B.a<b+c C.a=b+c D.a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)  FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.100mL 2 mol·L-1碳酸钠溶液中,CO32-离子数为0.2NA
B.将10mL 1mol·L-1FeCl3溶液滴入沸水中,所得氢氧化铁胶粒数为0.01NA
C.1 mol Na2O2固体中含离子总数为3NA
D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g
查看答案和解析>>
科目:高中化学 来源: 题型:
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)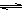 CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)
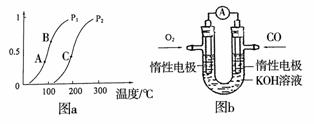
② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是: 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4)= v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH = 。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是: 、 、能连续工作。
查看答案和解析>>
科目:高中化学 来源: 题型:
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是_____________________________________
________________________________________________________________________。
(3)③中所发生的各反应的离子方程式是_____________________________________
________________________________________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________,c(Fe2+)为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com