
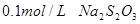 溶液、
溶液、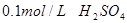 、烧杯、冷水、热水、秒表等
、烧杯、冷水、热水、秒表等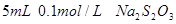 。
。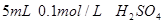 。
。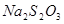 和
和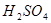 反应的化学方程式为 。
反应的化学方程式为 。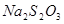 和
和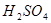 的试管),一组放入冷水中,另一组放入热水中。(一定要答出先分组浸泡,表述合理即可得分。若答为先混合,再分组浸泡不得分)
的试管),一组放入冷水中,另一组放入热水中。(一定要答出先分组浸泡,表述合理即可得分。若答为先混合,再分组浸泡不得分)
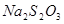 和
和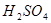 的试管),一组放入冷水中,另一组放入热水中。
的试管),一组放入冷水中,另一组放入热水中。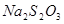 发生自身的氧化还原反应生成单质硫、SO2和水,方程式为
发生自身的氧化还原反应生成单质硫、SO2和水,方程式为 。
。

科目:高中化学 来源:不详 题型:实验题

| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式 | 催化效果/g·g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL蒸馏水 | 4 mL 蒸馏水 +3滴浓H2SO4 | 4 mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
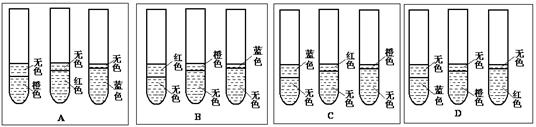
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL饱和食盐水 | 4 mL饱和食盐水 +3滴浓H2SO4 | 4 mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
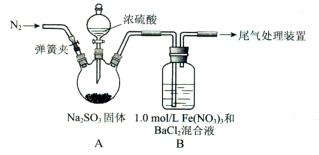
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体
油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体 生成。有人提出:CO2、SO2与过氧化
生成。有人提出:CO2、SO2与过氧化 钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断
钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断 。
。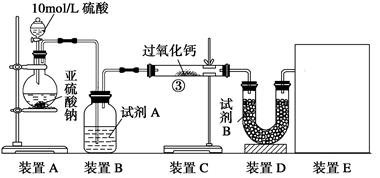
 的体积
的体积 ,请在框中画出装置图。
,请在框中画出装置图。 置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。
置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。 :________________________________________________________________。
:________________________________________________________________。 验评价:
验评价:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com