
 2C(s)��3D(g) ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���
2C(s)��3D(g) ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���| �¶�/�� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 64��0 | 50.7 | 42��9 |
 2C(s)��3D(g)��C��B=2:3���������ĵ�C�����ʵ���Ϊ0.06mol/L��2L��2/3=0.08mol���÷�ӦΪ���淴Ӧ�����ﵽƽ���Ӧ�ô���C���ʡ���˿�ʼʱ�����C�����ʵ���Ӧ�ñ�0.08mol�ࡣ��X��0.08mol����A�����ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵĿ��淴Ӧ�����۷�Ӧ�Ƿ�ﵽƽ�⣬�����ڻ�������ѹǿ������ʱ��仯���䡣����B����ΪB����̬���ʡ����������ʲ���ʱ��ı仯���仯��˵����Ũ�Ȳ��ٷ����仯����Ӧ�ﵽƽ�⡣��ȷ��C�������ڷ���ʽ�ж��ߵ�ϵ����ͬ�������κ�ʱ��c(B)�Uc(D)=1�U1������˵����Ӧ�ﵽƽ��״̬������D����Ϊ�μӷ�Ӧ�������й��壬����M(B)��M(D)������Ӧ�ﵽƽ��״̬������������������䣬���������䣬���������ܶȱ��ֲ��䣻����Ӧδ�ﵽƽ�⣬���������������Ҫ�����仯������������ܶȾ�Ҫ�����仯����˸�����������Ϊ��Ӧ�ﵽƽ��ı�־����ȷ��
2C(s)��3D(g)��C��B=2:3���������ĵ�C�����ʵ���Ϊ0.06mol/L��2L��2/3=0.08mol���÷�ӦΪ���淴Ӧ�����ﵽƽ���Ӧ�ô���C���ʡ���˿�ʼʱ�����C�����ʵ���Ӧ�ñ�0.08mol�ࡣ��X��0.08mol����A�����ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵĿ��淴Ӧ�����۷�Ӧ�Ƿ�ﵽƽ�⣬�����ڻ�������ѹǿ������ʱ��仯���䡣����B����ΪB����̬���ʡ����������ʲ���ʱ��ı仯���仯��˵����Ũ�Ȳ��ٷ����仯����Ӧ�ﵽƽ�⡣��ȷ��C�������ڷ���ʽ�ж��ߵ�ϵ����ͬ�������κ�ʱ��c(B)�Uc(D)=1�U1������˵����Ӧ�ﵽƽ��״̬������D����Ϊ�μӷ�Ӧ�������й��壬����M(B)��M(D)������Ӧ�ﵽƽ��״̬������������������䣬���������䣬���������ܶȱ��ֲ��䣻����Ӧδ�ﵽƽ�⣬���������������Ҫ�����仯������������ܶȾ�Ҫ�����仯����˸�����������Ϊ��Ӧ�ﵽƽ��ı�־����ȷ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
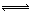 NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I��
NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I��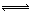 2ClNO��g�� K2 ?H < 0 ��II��
2ClNO��g�� K2 ?H < 0 ��II��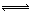 2NaNO3��s��+2NO��g��+Cl2��g����ƽ�ⳣ��K= ����K1��K2��ʾ����
2NaNO3��s��+2NO��g��+Cl2��g����ƽ�ⳣ��K= ����K1��K2��ʾ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO(g)��6HO(g) ��H����Q kJ�� mol��1(Q��0)�������ڲ������ʵ����ʵ���Ũ�����±���
4NO(g)��6HO(g) ��H����Q kJ�� mol��1(Q��0)�������ڲ������ʵ����ʵ���Ũ�����±���| ʱ�䣯Ũ�� | c(NH3)( mol��L-1) | c(O2)( mol��L-1) | c(NO)( mol��L-1) |
| ��ʼ | 0.8 | 1.6 | 0 |
| ��2min | 0.6 | a | 0.2 |
| ��4min | 0.3 | 0.975 | 0.5 |
| ��6min | 0.3 | 0.975 | 0.5 |
| ��8min | 0.7 | 1.475 | 0.1 |
| ��10min | 0.7 | 1.475 | 0.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
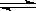 Z �ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�������������ȷ���� �� ��
Z �ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�������������ȷ���� �� �� 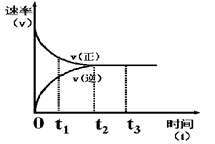
| A��t1ʱ������Ӧ���ʴ����淴Ӧ���� |
| B��t2ʱ���ﵽ�������µ����Ӧ�� |
| C��t2- t3����Ӧ���ٷ����������ʵ�Ũ����� |
| D��t3�÷�Ӧ�ķ�Ӧ���п��ܱ���������ı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ����( )��
2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�����������ȷ����( )��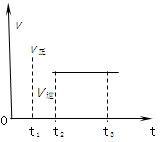
| A��t1ʱ��ֻ��������Ӧ |
| B��t2- t3�������ʵ�Ũ�Ȳ��ٷ����仯 |
| C��t2- t3����Ӧ���ٷ��� |
| D��t2ʱ����Ӧδ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 x Q(g)+3R(g)����2min��ƽ�⣬����2.4molR�������Q��Ũ��Ϊ0.4mol/L����
x Q(g)+3R(g)����2min��ƽ�⣬����2.4molR�������Q��Ũ��Ϊ0.4mol/L�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 HOI(aq) ��H2
HOI(aq) ��H2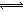 I2(aq)+H2O(l) ��H3
I2(aq)+H2O(l) ��H3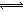 I3��(aq)����ƽ�ⳣ������ʽΪ_______��
I3��(aq)����ƽ�ⳣ������ʽΪ_______��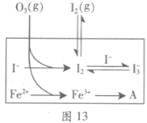
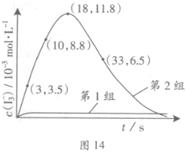
| ��� | ��Ӧ�� | ��ӦǰpH | ��Ӧ��pH |
| ��1�� | O3+ I�� | 5.2 | 11.0 |
| ��2�� | O3+ I��+ Fe2+ | 5.2 | 4.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| | ��������ĩ״��/mol | ���Ũ�ȼ���� | ��Ӧ�¶� | ||
| A | Mg | 0.1 | 3mol��L-1���� | 10mL | 25�� |
| B | Fe | 0.1 | 3mol��L-1���� | 10mL | 25�� |
| C | Mg | 0.1 | 3mol��L-1���� | 10mL | 25�� |
| D | Mg | 0.1 | 6mol��L-1���� | 10mL | 60�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
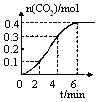
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com