
分析 ①中二氧化氮与水反应,但是NO不会发生反应;②中发生4NO2+O2+2H2O=4HNO3,③中HCl溶于水,剩余氧气;④中氨气溶于水,则①②中溶质为硝酸,而③中溶质为HCl气体,④中溶质为氨气,结合c=$\frac{n}{V}$计算即可.
解答 解:①设气体体积均为2VL,发生反应:3NO2+H2O=2HNO3+NO,反应后硝酸的物质的量为$\frac{2V}{3×22.4}$mol,反应后NO共$\frac{4V}{3}$V,溶液体积为$\frac{2V}{3}$V,则浓度为$\frac{1}{22.4}$mol/L;
②设气体体积均为4VL,发生反应:4NO2+O2+2H2O=4HNO3,反应后硝酸的物质的量为$\frac{4V}{22.4}$mol,反应后剩余氧气3VL,溶液体积为5VL,则溶液浓度为$\frac{\frac{4V}{22.4}}{5V}$=$\frac{4}{5}$×$\frac{1}{22.4}$mol/L;
③设气体体积均为VL,HCl全部溶于水,氧气不溶于水,HCl的物质的量为$\frac{V}{22.4}$mol,溶液体积为VL,则浓度为$\frac{1}{22.4}$mol/L;
④设气体体积均为VL,NH3全部溶于水,氮气不溶于水,氨气的物质的量为$\frac{V}{22.4}$mol,溶液体积为VL,则浓度为$\frac{1}{22.4}$mol/L;
所以试管中溶液的物质的量浓度从大到小排列的顺序是①=③=④>②.
故答案为:①=③=④>②.
点评 本题考查化学反应及物质的量浓度的计算,为高频考点,把握发生的反应、溶质及溶液体积的判断为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A. | 四种溶液中,水的电离程度①>②>④>③ | |
| B. | Na2CO3和NaHCO3 溶液中,粒子种类相同 | |
| C. | 将等浓度的CH3COOH 和HClO溶液比较,pH小的是HClO | |
| D. | Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
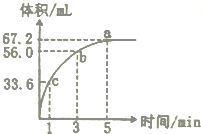 某“学习小组”研究影响化学反应速率的因素.向10 mL某浓度的H2O2溶解中加入一定量MnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示,
某“学习小组”研究影响化学反应速率的因素.向10 mL某浓度的H2O2溶解中加入一定量MnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (填字母符号)
(填字母符号)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
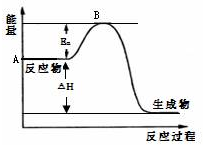 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1molSO2(g)完全转化为1molSO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1molSO2(g)完全转化为1molSO3(g)放热99kJ.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A+3B═2C | B. | A+3B═2C | C. | 3A+B═2C | D. | 3A+B═C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的种类很多,但它们水解后都一定有一产物产生 | |
| B. | 淀粉、纤维素都属糖类,它们的通式相同,但它们不互为同分异构体 | |
| C. | 已知CH4+H2O$\stackrel{催化剂}{→}$CH3OH+H2该反应的有机产物是无毒物质 | |
| D. | C(CH3)4二氯代物只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com