
| A. | 一定温度和压强下,各种气体物质体积的大小由构成气体的分子大小决定 | |
| B. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的原子数决定 | |
| C. | 无论外界条件是否相同,不同的气体,若物质的量不同,则它们所含的分子数也不同 | |
| D. | 相同状况下,相同微粒数的Fe、H2O、H2的体积相同 |
分析 A、一定温度和压强下,各种气体物质体积的大小由分子间距离决定;
B、一定温度和压强下,气体摩尔体积一定,气体的体积有气体的物质的量决定;
C.气体体积与温度、压强、气体分子数有关,体积不同,所含分子数不一定不同;
D.在标准状态下,1mol任何气体所占的体积约为22.4L.
解答 解:A、一定温度和压强下,各种气体物质体积的大小由分子间距离决定,故A错误;
B、气体体积=气体的物质的量×气体摩尔体积,在温度和压强一定的条件下,气体摩尔体积一定,气态物质体积的大小,由构成气体的物质的量决定,即气体分子数决定,气体分子可能是单原子分子也可以是多原子分子,故B错误;
C.决定气体的体积因素是温度、压强、气体的分子数,不同气体,若物质的量不同,体积不同,它们所含的分子数不一定不同,故C正确;
D.铁为固体,水为液体,体积取决于过程为本身大小,氢气是气体体积取决于一定温度和压强下气体分子数,相同状况下,相同微粒数的Fe、H2O、H2的体积不相同,故D错误;
故选C.
点评 本题考查了气体体积、气体摩尔体积等知识点,明确气体体积的影响因素、气体摩尔体积的含义是解本题关键,注意:气体摩尔体积受温度和压强影响,为易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有②③④ | C. | 只有①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2 的摩尔质量为95 g | |
| B. | 常温常压下,1 mol CO2的质量是44 g | |
| C. | 标准状况下,1 mol H2O所占的体积约为22.4 L | |
| D. | 100 mL 1mol/L的稀硫酸中含有H+ 的数目约为6.02×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造炊具 | B. | 制儿童玩具油漆 | C. | 制牙膏皮 | D. | 炼铝厂制造铝锭 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
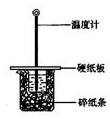 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++OH -=H2O | |
| B. | Cl -+Ag+=AgCl↓ | |
| C. | Cu 2++2OH -+Ba 2++SO42-=BaSO4↓+Cu(OH)2↓ | |
| D. | H++SO42-+OH-+Ba 2+=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 试剂 | 试管中的物质 |  | |
| A | 苯环对甲基的影响 | 酸性KMnO4溶液 | ①苯②甲苯 | |
| B | 比较Br-、Fe2+和I-的还原性 | 氯水 | ①FeBr2溶液②FeI2溶液 | |
| C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 | |
| D | 探究接触面积对反应速率的影响 | VmL、cmol/L的盐酸 | ①ag大理石块②ag大理石粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
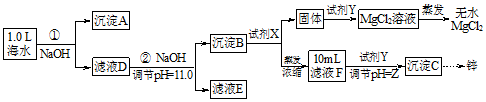
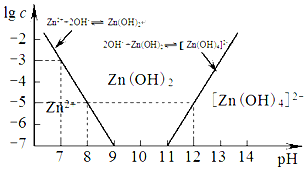
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
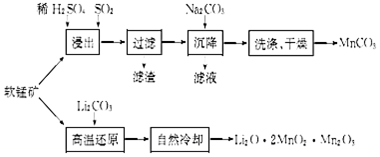
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com