
| A. | 1H、2H、3H互为同素异形体 | |
| B. | 碳酸氢钠和纯碱是同一物质 | |
| C. | 乙醇(CH3CH2OH)与甲醚(CH3OCH3)互为同分异构体 | |
| D. | O2与O3互为同位素 |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
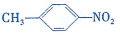 和
和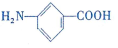
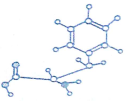
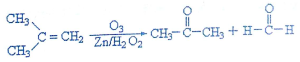

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
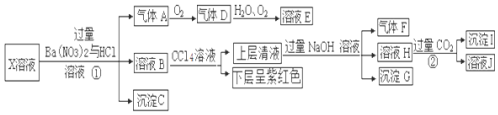
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
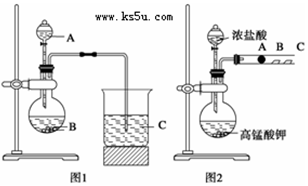
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随原子序数递增,元素原子的最外层电子排布呈现周期性变化 | |
| B. | 随原子序数递增,元素的原子半径呈现由大到小的周期性变化(惰性气体除外) | |
| C. | 随原子序数递增,元素的最高化合价重复出现从+1〜+7、最低化合价从-7〜-1的变化 | |
| D. | 随原子序数递增,元素的金属性和非金属性呈现周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杜绝化石燃料的使用,从源头上解决问题 | |
| B. | 减少燃料燃烧产生的热量损耗的技术,提高燃料利用率的措施 | |
| C. | 防止燃料燃烧造成环境污染的方法 | |
| D. | 通过化学方法把化石燃料转化成洁净燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:F2>Cl2 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 金属单质置换出氢的能力:K>Na | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
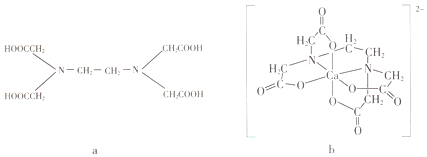 a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )| A. | b含有分子内氢键 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有共价键、离子键和配位键 | D. | a和b中的N原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
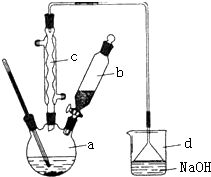 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com